[Probiotische Behandlung des kindlichen Reizdarmsyndroms]
U. Martens 1P. Enck 1
E. Zieseniß 2
1 Medizinische Klinik und Poliklinik, Abteilung Psychosomatische Medizin und Psychotherapie, Universitätsklinikum Tübingen, Deutschland
2 inpharm consulting, Bielefeld, Deutschland
Zusammenfassung
Die Behandlung des kindlichen Reizdarmsyndroms (RDS) ist schwierig, da bislang wenige nebenwirkungsarme Medikamente vorliegen. Wir berichten hier die Ergebnisse einer offenen Anwendungsbeobachtung bei 203 Kindern (66 Jungen und 137 Mädchen) im Alter von 4 bis 18 Jahren (mittleres Alter: 10,5±4,5 Jahre), die die typischen Symptome eines RDS vom Typ „Schmerzen und Diarrhöe” (n=50), „Schmerzen und Obstipation” (n=56), „Schmerzen und alternierende Stuhlfrequenz” (n=28) und „unspezifische Schmerzen” (n=69) gemäß Rom-III-Kriterien hatten. Die durchschnittliche Dauer der Beschwerden bis zum Therapiebeginn waren 175 Tage. Die Patienten bis 11 Jahre wurden in der Regel (95%) mit 10 Tropfen Symbioflor-2 (SF2) (SymbioPharm, Herborn) (Zellen und Autolysat von 1,5–4,5x107 Bakterien vom Typ Escherichia coli) behandelt, bei den älteren Kindern erhielten 77% diese Dosierung, die übrigen eine höhere Dosierung bin zu 30 Tropfen/Tag. Die Behandlung dauerte im Mittel 43 Tage. Ergebnisse: Alle Patienten vertrugen die Behandlung ohne Nebenwirkungen. Die Kernsymptome des RDS (Bauchschmerzen, Stuhlfrequenz) wie auch die weiteren Symptome (Meteorismus, Stuhlbeimengungen von Schleim, Notwendigkeit starken Pressens, imperativer Stuhldrang) besserten sich alle signifikant im Verlauf der Behandlung. Die globale Bewertung der Therapie durch Eltern und Ärzte war positiv. Insgesamt bestätigen die in der vorliegenden Anwendungsbeobachtung dokumentierte Wirksamkeit und Verträglichkeit die bisherigen Erfahrungen mit SF2 bei Kindern und Jugendlichen und die publizierten Daten der Behandlung von Erwachsenen mit RDS.
Einleitung
Das Reizdarmsyndrom (RDS) gehört in die Gruppe der funktionellen Magen-Darm-Erkrankungen und ist durch eine charakteristische Symptomkonstellation gekennzeichnet, d.h. abdominelle Schmerzen oder Beschwerden, verbunden mit einer gestörten Defäkation. Typisch für das RDS sind diffuse Leibschmerzen, Meteorismus/Blähungen, Flatulenz, Stuhlunregelmäßigkeiten mit Erleichterung nach dem Stuhlgang oder ein Gefühl der inkompletten Stuhlentleerung. Es fehlen allerdings sowohl morphologische Abnormitäten, die die Symptome hinreichend erklären könnten, objektive Diagnosekriterien, sowie gesicherte Kenntnisse der Pathogenese, und demzufolge pathophysiologisch begründete Therapiemaßnahmen.
Die Diagnose beruht auf der Erfassung des typischen Symptommusters, dem Fehlen von Alarmsymptomen und dem Ausschluss wesentlicher Differentialdiagnosen. In dieser Anwendungsbeobachtung wird das Reizdarmsyndrom durch die kürzlich publizierten, neugefassten Diagnosekriterien des Rom-Konsensus III definiert [1], [2], (Tabelle 1 [Tab. 1]). Diese Klassifikation wurde inzwischen auch für die kindlichen Formen des Reizdarmsyndroms verwendet [3] und hat in der gegenwärtigen Diskussion die ältere Nomenklatur, die von „wiederkehrenden Bauchschmerzen” (engl.: recurrent abdominal pain) spricht, abgelöst [4].

Das RDS ist eine häufige Erkrankung. Weltweit liegt die Prävalenz bei Erwachsenen und Jugendlichen etwa zwischen 10% und 20%, wobei Frauen häufiger als Männer betroffen sind [1]. Die Erkrankung hat erheblichen Einfluss auf die Lebensqualität der Betroffenen und verursacht hohe direkte und indirekte Kosten, z.B. durch häufige Krankschreibung [5].
Für pädiatrische Patienten liegen relativ wenige Daten vor. Im Rahmen des Kinder- und Jugendgesundheitssurveys (KiGGS) wurden repräsentative Daten zu Schmerzen bei Kindern und Jugendlichen im Alter von 3–17 Jahren in Deutschland erhoben [6]. Bei den 3- bis 10-Jährigen war der Bauch die häufigste Schmerzlokalisation. Kinder und Jugendliche im Alter von 11–17 Jahren berichteten am häufigsten über Kopfschmerzen, gefolgt von Bauch- und Rückenschmerzen [7].
Neben nichtmedikamentösen Allgemeinmaßnahmen wie z.B. körperlicher Bewegung, Stressabbau, Entspannungsübungen (autogenes Training) kann eine Arzneitherapie als flankierende Maßnahme in Frage kommen, die sich an dem vorherrschenden Leitsymptom orientiert, z.B. stuhlregulierende, entblähende, spasmolytische oder motilitätsregulierende Arzneimittel. Nur wenige der Medikamentenentwicklungen der letzten Jahre [8] haben den Weg in die medizinische Routine gefunden, kaum eines der neueren Medikamente war dabei auf seine Wirksamkeit bei Kindern überprüft worden.
Seit einigen Jahren erleben die probiotischen und prebiotischen Medikamente eine Renaissance [9] und werden vermehrt bei funktionellen Magen-Darm-Beschwerden eingesetzt [10]. Ihr geringes Nebenwirkungsprofil [11] lässt sie auch als denkbare Mittel zur Behandlung der kindlichen gastrointestinalen Funktionsstörungen erscheinen, aber entsprechende Studien sind bei diesen Krankheitsbildern eher selten [12] – sie finden in der Pädiatrie vor allem Anwendung bei dermatologischen und allergischen Erkrankungen [13].
Symbioflor® 2 (SF2) (SymbioPharm GmbH, Herborn) enthält sowohl lebende als auch abgetötete Escherichia coli-Bakterien (Zellen und Autolysat von 1,5–4,5x107 Bakterien) und ist nach den bisher vorliegenden Erkenntnissen zur Therapie bei funktionellen Störungen des Magen-Darmtraktes wie z.B. bei Reizdarm gut wirksam [14]. Wir berichten hier die Daten einer offenen Anwendungsbeobachtung mit SF2 bei 203 Kindern im Alter von 4 bis 18 Jahren mit RDS-Syndrom gemäß den Diagnosekriterien des Rom-Konsensus III.
Patienten und Methoden
Art der Untersuchung
Es handelte sich um eine Anwendungsbeobachtung (AWB) nach § 67 Abs. 6 Arzneimittelgesetz (AMG). Diese AWB wurde durchgeführt nach den „Empfehlungen zur Planung und Durchführung von Anwendungsbeobachtungen“ des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) vom 12. November 1998, nach der ICH-Guideline E11 (CPMP/ICH/2711/99): „Clinical investigation of medicinal products in the pediatric population“ (Dezember 2000) und nach der Guideline CPMP/EWP/462/95 „Note for guidance on clinical investigation of medicinal products in children“ (17. März 1997).
Es erfolgte kein Eingriff in den Routineablauf der ärztlichen Therapiemaßnahmen. Insbesondere wurden von den behandelnden Ärzten keine Maßnahmen vorgenommen, die nicht auch außerhalb der Studie aufgrund der medizinischen Erfordernisse der einzelnen Patienten mit dem hier verwendeten Arzneimittel angewandt worden wären. Dies galt auch für eventuell notwendige Begleittherapien. Die teilnehmenden Ärzte waren daher in der Wahl etwaiger Begleittherapien frei. Art und Umfang einer eventuellen Begleittherapie und eventuell vorliegender Begleiterkrankungen wurden von den teilnehmenden Ärzten jedoch dokumentiert.
In der vorliegenden AWB war eine spezielle Aufklärung und Einwilligung der Patienten bzw. deren Eltern über den bei jeder ärztlichen Behandlung ohnehin erforderlichen Umfang hinaus nicht notwendig, da keine entsprechende gesetzliche Verpflichtung besteht, die Patienten nach der Behandlungsentscheidung des behandelnden Arztes die für sie erforderliche Therapie erhielten, und darüber hinaus keine studienbedingte Gefährdung bestand, und die Speicherung der bei einer AWB oder einer klinischen Prüfung ermittelten Patientendaten beim Arzt – auch unter Einbeziehung der Patientennamen – regelmäßig zulässig ist. Ausschließlich anonymisierte Daten wurden zur Auswertung weitergegeben wurden, die damit datenschutzrechtlich und im Rahmen der ärztlichen Schweigepflicht nicht als personengebunden gelten.
Gemäß § 67 Abs. 6 AMG wurde die Durchführung der vorliegenden AWB vom Sponsor (SymbioPharm, Herborn) der AWB der Kassenärztlichen Bundesvereinigung, dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und den Spitzenverbänden der Krankenkassen angezeigt.
Die vorliegende AWB wurde mit einem zugelassenen Arzneimittel durchgeführt. Gemäß AMG verlangte dies neben einer individuellen ärztlichen Indikationsstellung und Patientenauswahl die Verordnung des Arzneimittels und Verwendung von Handelsware.
Ärzte und Patienten
Die vorliegende AWB wurde zwischen dem 08.10.2007 (erste Aufnahmeuntersuchung) und dem 12.08.2008 (letzte Abschlussuntersuchung) in 14 pädiatrischen und allgemeinärztlichen Praxen mit insgesamt 203 Kindern der Altersklassen 4–11 Jahre und 12–18 Jahre durchgeführt.
Allgemeiner Ablauf, Dauer, Dosierung
Kinder im Alter von 4–11 Jahre und 12–18 Jahren mit Reizdarmsyndrom, die ohnehin mit Symbioflor-2 (SF2) (SymbioPharm, Herborn) behandelt wurden, sollten in die Anwendungsbeobachtung aufgenommen werden. Die Patienten sollten bis zur deutlichen Linderung bzw. zum Verschwinden der Beschwerden, maximal aber 3 Monate beobachtet werden.
SF2 sollte nach ärztlicher Anweisung angewendet werden. Der behandelnde Arzt sollte neben der Therapiedauer die von ihm verordnete Dosierung dokumentieren (Empfehlung der Gebrauchsinformation oder andere Dosierung). Die in der Gebrauchsinformation empfohlene Dosierung für Kinder beträgt: 1 mal täglich 10 Tropfen in etwas Wasser gelöst zur Mittagsmahlzeit, bei Jugendlichen kann die Dosierung auf die Dosis für Erwachsene (bis auf 30 Tropfen/Tag) erhöht werden.
Entsprechend dem nicht-intervenierenden Charakter der Beobachtungsmaßnahme waren weder die Art noch die Zeitpunkte etwaiger Verlaufsuntersuchungen im Behandlungszeitraum vorgegeben. Die Anzahl und die Abstände der einzelnen Besuchstermine wurden vom behandelnden Arzt individuell bestimmt.
Um den Behandlungserfolg beurteilen zu können, empfahl sich jedoch die Durchführung einer Zwischenuntersuchung etwa 14 Tage nach der Aufnahmeuntersuchung, gefolgt von einer Abschlussuntersuchung nach etwa 3 Monaten Behandlung. Bei der Zwischenuntersuchung war auch Gelegenheit für eine eventuelle Anpassung der Dosis. Die Untersuchungen bei den einzelnen Terminen sind in Tabelle 2 [Tab. 2] wiedergegeben.

Zu dokumentierende Symptomatik
Zu jedem Termin wurden das Vorhandensein und die Ausprägung folgender RDS-Symptome erhoben. Anzahl der Stühle (pro Tag oder pro Woche), Stuhlkonsistenz (hart/klumpig, geformt, breiig, flüssig, wechselnd), Stuhlbeimengung von Schleim (nein/ja), Bauchschmerzen (nein/ja), Meteorismus (nein/ja), Flatulenz (nein/ja), Stuhlpassage.
Biometrische Planung und Auswertung
Für die Auswertung wurden alle eingegangenen Erhebungsbogen herangezogen. Alle dokumentierten Patienten wurden in die Auswertung eingeschlossen („intent-to-treat” Analyse). Die dokumentierten Variablen wurden mit Kennzahlen der deskriptiven Statistik (arithmetisches Mittel, Standardabweichung, Minimum, Maximum, Median) dargestellt. Bei den qualitativen Merkmalen wurden Häufigkeitstabellen erstellt. Die inferenzstatistischen Methoden dienten ausschließlich der explorativen Analyse und sind nicht als konfirmatorische Beweise anwendbar.
Ergebnisse
Demographische Daten/Diagnose
An der AWB nahmen 203 Kinder und Jugendliche der Altersgruppen 4–11 Jahre und 12–18 Jahre mit einem der vier klinischen Typen des Reizdarmsyndroms „Schmerz + Diarrhö“, „Schmerz + Obstipation“, „Schmerz + alternierend Diarrhö/Obstipation“ und „Schmerz unspezifiziert“ teil. Alle Patienten litten unter einem Reizdarmsyndrom entsprechend den ROM-III-Kriterien (Tabelle 3 [Tab. 3]).
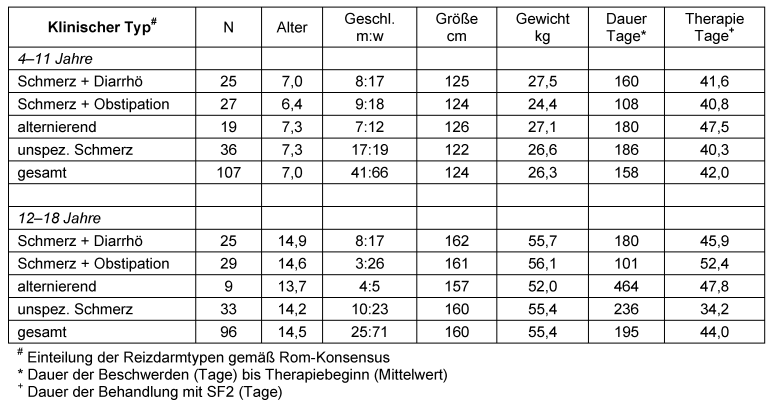
Tabelle 3 [Tab. 3] zeigt deskriptive Kenngrößen des Geschlecht, Alters, der Größe und des Gewichts sämtlicher Patienten getrennt nach Altersgruppe und klinischem Typ des Reizdarmsyndroms. Es ergaben sich keine Unterschiede zwischen den vier klinischen Typen des Reizdarmsyndroms hinsichtlich des Geschlechtes, des Alters (p=0.4318), des Gewichts (p=0.9256, adjustiert bzgl. Alter) sowie der Größe der Patienten (p=0.5218, adjustiert bzgl. Alter).
Die Diagnose eines RDS gemäß den ROM-III-Kriterien kann erst nach Beobachtung der Beschwerden über einen Mindestzeitraum von 2 Monaten gestellt werden. Entsprechend begannen die an dieser AWB teilnehmenden Ärzte in beiden Altersgruppen auch nach etwa 80 Tagen mit der Behandlung des Reizdarmsyndroms. Dabei bestanden relativ große Unterschiede zwischen den vier klinischen Typen: Generell wurden die Typen „Schmerz + Diarrhö“ und „Schmerz + Obstipation“ relativ frühzeitig therapiert, d.h. im Median nach weniger als 100 Tagen. Die klinischen Typen „Schmerz + alternierend Diarrhö/Obstipation“ und „Schmerz unspezifiziert“ wurden dagegen im Median erst nach mehr als 100 Tagen therapiert (Tabelle 3 [Tab. 3]).
Dosierung von SF2, andere Arzneimitteln
Weit überwiegend verordneten die Prüfärzte mit 1-mal täglich 10 Tropfen die für Kinder empfohlene SF2- Standarddosierung: 77,4% aller Patienten erhielten diese Dosierung. Generell wurden selten (5% der Fälle) Dosisänderungen vorgenommen.
Es haben insgesamt nur 6 Patienten andere Arzneimittel zur Behandlung des Reizdarmsyndroms parallel zur der Therapie mit SF2 erhalten, zumeist nur für wenige Tage: 4 x Lactulose, 1 x Gastrosil, 1 x Iberogast.
Dauer der Behandlung
Die mittlere Dauer der Therapie mit SF2 lag in beiden Altersgruppen und bei jedem klinischen Typ des Reizdarmsyndroms im Durchschnitt bei ca. 40–50 Tagen (Tabelle 3 [Tab. 3]). Dabei stellt der klinische Typ „Schmerz unspezifiziert“ in der Altersgruppe der 12–18-jährigen Patienten eine Ausnahme dar, die im Durchschnitt nur 34,2 Tage therapiert wurden. Die Unterschiede zwischen den beiden Altersgruppe und den vier klinischen Typen des Reizdarmsyndroms sind allerdings nicht statistisch signifikant (p=0.1919).
Wirksamkeit der Behandlung
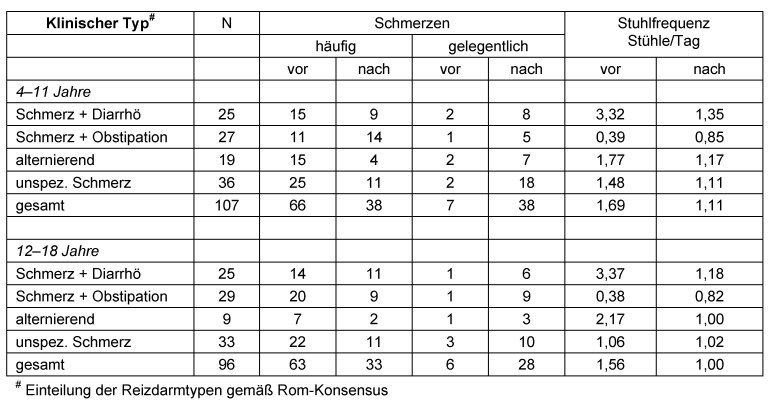
Tabelle 4 [Tab. 4] zeigt die Wirksamkeit der SF2-Behandlung für die klinischen Kernparameter des Reizdarmsyndroms „Bauchschmerzen” und „Stuhlfrequenz” (s. oben) zwischen Eingangsuntersuchung und Abschlussuntersuchung, getrennt nach Altersgruppen und Symptomen. Die Änderungen sind signifikant (p<.001)
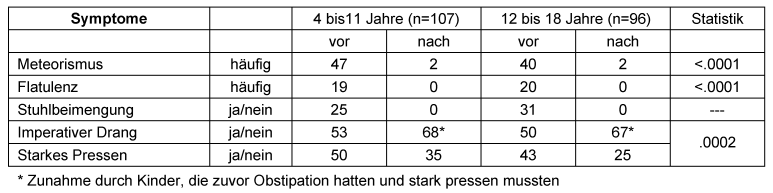
Auch die Symptome „Meteorismus”, „Flatulenz”, Beimengung von Schleim im Stuhl, und veränderte Stuhlpassage (imperativer Stuhldrang, Notwendigkeit starken Pressens) waren unter SF2 signifikant (p<.001) gebessert (Tabelle 5 [Tab. 5]).
Globale Beurteilung der Wirksamkeit
Tabelle 5 [Tab. 5] zeigt ebenfalls die globale Wirksamkeitsbewertung durch den Arzt. In der überwiegenden Mehrheit der Fälle wurde die Wirksamkeit der Therapie als „sehr gut” und „gut” bewertet (gesamt: 81,8%). Dies gilt für jede Altersgruppe und jeden klinischen Typ des Reizdarmsyndroms. Eine gewisse Ausnahme stellen dabei die 12–18-jährigen Patienten mit klinischem Typ „Schmerz + alternierend Diarrhö/Obstipation” dar, bei denen die Therapie in nur 55,5% der Fälle als „sehr gut” und „gut” bewertet wurde. Das Ergebnis relativiert sich allerdings durch die sehr geringe Fallzahl in der entsprechenden Subgruppe (9 Patienten), von denen bei nur 4 Patienten schlechtere Bewertungen abgegeben wurden.
Vergleich mit früher verwendeten Arzneimitteln
Nur ca. 40% der Patienten/Eltern machten hierzu Angaben, hatten also therapeutische Erfahrungen mit anderen Arzneimitteln zur Behandlung des Reizdarmsyndroms. SF2 wurde in der Mehrzahl der Fälle (77%) als besser bewertet wurde als andere, früher gegebene Arzneimittel, in nur wenigen Fällen wurde SF2 als „eher schlechter” als das Vergleichspräparat bewertet, nie als „viel schlechter”. Es bestehen dabei keine signifikanten Unterschiede zwischen den vier klinischen Typen des Reizdarmsyndroms und zwischen beiden Altersgruppen. Die bekannten, früher bereits gegebenen anderen Arzneimittel waren (neben 1 x Diät) im Wesentlichen pflanzliche, die Motilität beeinflussende Mittel (Iberogast: 15x), Hefepräparate (Perenterol: 11x), und chemisch definierte Laxantien (Lactulose: 10x).
Verträglichkeit der Behandlung, Nebenwirkungen
Bis auf zwei Ausnahmen (befriedigend) der insgesamt 203 Fälle wurde die Verträglichkeit von SF2 von den Patienten/Eltern in 98,6% der Fälle als „sehr gut” und „gut” bewertet. Die Analyse der Verträglichkeitsbewertung durch die Patienten/Eltern stimmt qualitativ mit denen der ärztlichen Beurteilung überein: Bis auf zwei Ausnahmen der insgesamt 203 Fälle (1 x befriedigend; 1 x ausreichend) wurde die Verträglichkeit von SF2 in 98,5% als „sehr gut” und „gut” bewertet. Es wurden keine Nebenwirkungen dokumentiert.
Diskussion
Das Reizdarmsyndrom (RDS) gehört in die Gruppe der funktionellen Magen-Darm-Erkrankungen und ist durch eine charakteristische Symptomkonstellation gekennzeichnet, d.h. abdominelle Schmerzen oder Beschwerden, verbunden mit einer gestörten Defäkation.
Die Diagnose beruht auf der Erfassung des typischen Symptommusters, dem Fehlen von Alarmsymptomen und dem Ausschluss wesentlicher Differentialdiagnosen organischer Erkrankungen. In dieser AWB wird das Reizdarmsyndrom durch die kürzlich publizierten, neu gefassten Diagnosekriterien des Rom-Konsensus III definiert, insbesondere durch die Rom III-Kriterien für Kinder und Jugendliche im Alter von 4–18 Jahren [3]. In der vorliegenden Anwendungsbeobachtung sollten deshalb Wirksamkeit und Verträglichkeit von SF2 bei Kindern unter Praxisbedingungen dokumentiert und damit die bisher vorliegenden Erkenntnisse zu diesem Arzneimittel erweitert werden.
Sowohl die behandelnden Ärzte als auch die Patienten/Eltern bewerteten die Wirksamkeit des Probiotikums außerordentlich positiv. In der überwiegenden Mehrheit der Fälle (ca. 82%) beurteilten die Ärzte die Wirksamkeit der Therapie als sehr gut und gut. Dies gilt für jede Altersgruppe und jeden klinischen Typ des Reizdarmsyndroms. Auch die Patienten bzw. deren Eltern beurteilten die Wirksamkeit in jeder Altersgruppe und bei jedem klinischen Typ des Reizdarmsyndroms in der überwiegenden Mehrheit der Fälle (ca. 83%) als „sehr gut” und „gut”. SF2 wurde außerdem in der Mehrzahl der Fälle als besser bewertet als andere, früher gegebene Arzneimittel. Die bekannten, früher bereits gegebenen anderen Arzneimittel waren im Wesentlichen pflanzliche, die Motilität beeinflussende Mittel, Hefepräparate, und chemisch definierte Laxantien.
Die hier demonstrierte hervorragende Wirksamkeit eines probiotischen Medikamentes in der Behandlung funktioneller Magen-Darm-Störungen vom Typ Reizdarmsyndrom reiht sich damit in die seit einigen Jahren zunehmende Zahl von Studien auch doppelblinder, Placebo-kontrollierter Natur ein [10], die eine Wirksamkeit zeigen, die der neu entwickelter Medikamente gleichwertig oder überlegen ist [14], [15], [16], [17]. Dies wird auch in Metaanalysen [18], [19], [20], [21] bestätigt. Die meisten dieser Studien sind jedoch bei Erwachsenen durchgeführt worden.
Dagegen sind bislang erst einige wenige kontrollierte Studien zur Wirksamkeit probiotischer Medikamente bei kindlichen funktionellen Magen-Darm-Erkrankungen berichtet worden [12], [22], [23].
Henker et al. [12] behandelten 113 Kinder mit akuter Diarrhö mit einem E. coli Probiotikum (Mutaflor®) in einer Placebo-kontrollierten Studie und fanden das Probiotikum signifikant überlegen im Hinblick auf Ansprechrate, Erreichung des Therapieziels und Dauer bis zur Erreichung des Therapieziels. Bausserman et al. [22] behandelten 64 Kinder mit einem Laktobazillus GG-Präparat im Vergleich zu Placebo für 6 Wochen und berichteten, dass LGG zwar die Blähsymptome, aber nicht die Bauchschmerzen veränderten. Gawronska et al. [23] behandelte 103 Kinder mit einem vergleichbaren Präparat und fand einen moderaten Therapieeffekt für das Reizdarmsyndrom, aber nicht für die reine funktionelle Bauschschmerzsymptomatik oder für funktionelle Oberbauchbeschwerden. Eine kürzliche Zusammenfassung [24] der Literatur bei Kindern kommt allerdings zu dem Schluss, dass Probiotika bei Obstipation wenig wirksam sind, und eine Cochrane-Metaanalyse schlussfolgert, dass die Datenlage zur Behandlung des kindlichen Reizdarmsyndroms insgesamt eher unbefriedigend ist [25].
Jenseits der Laktobazillus-Präparationen, die in der Erwachsenenmedizin als gesichert wirksam gelten [20], [21], sind andere bakterielle Stämme selten eingesetzt worden, und es liegt bislang nur eine Studie vor, in der ein Probiotikum aus (abgetöteten) Escherichia coli eingesetzt wurde [26], und eine weitere Studie, in der eine Mischung aus Escherichia coli- und Enterokokkus faecalis-Bakterien erfolgreich beim Reizdarmsyndrom eingesetzt wurde [14], sowie die oben diskutierte Escherichia coli-Behandlung bei kindlichen akuten Diarrhöen [12].
Die relativ homogene Wirksamkeit verschiedener Bakterienstämme bei dem eher heterogenen Krankheitsbild Reizdarmsyndrom bei Kindern und Erwachsenen [10] drängt die Frage nach dem Wirkmechanismus der Pro- und Präbiotika besonders auf [26]: Es ist unwahrscheinlich, dass dieser auf der zeitweiligen Veränderung der darmständigen Flora durch neue Stämme beruht, wie früher oftmals angenommen, sondern stattdessen auf der Stimulation des darmeigenen Immunsystems durch die Bakterien, um darüber eine anhaltende Wirkung zu entfalten. Dies wird Aufgabe zukünftiger Forschung sein.
Die Beschränkungen dieser Studie sind offensichtlich: da es sich um eine Anwendungsbeobachtung handelt, wurde keine Kontrollgruppe eingeschlossen, die entweder keine Behandlung oder die ein Placebo erhalten hat. Daher sind die Ergebnisse nicht gegen den Spontanverlauf der Symptome oder gegen Placebowirkungen kontrolliert. Beide Phänomene tragen aber signifikant zu den klinischen Symptomen des RDS bei [27], [28]. Daher müssen die Effizienzdaten mit Vorsicht interpretiert werden. Ein Vergleich mit der „üblichen Behandlung” (treatment as usual, TAU) des kindlichen Reizdarmsyndroms wäre eine weitere Möglichkeit gewesen, die Studienaussage zu verbessern, ohne dass dazu zwingend eine Randomisierung notwendig gewesen wäre, sondern die ausschließlich auf der Behandlungsentscheidung des Arztes basiert hätte. Schließlich hat die Studie zwar die gegenwärtigen Kriterien zur Diagnose eines kindlichen RDS benutzt, aber nicht die gegenwärtigen Standards zur Beurteilung eines Therapieerfolges nach „subjektiven globalen Kriterien” (“subjective global assessment”, SGA), zum Beispiel eine mindestens 50%ige Besserung der SGA [29]; daher mag diese Studien den Therapieerfolg überschätzen. Letztendlich kann nur eine randomisierte, doppelblinde und Placebo-kontrollierte Studie den Beweis für die Wirksamkeit probiotischer Behandlung des kindlichen Reizdarmsyndroms antreten.
Anmerkungen
Interessenkonflikte
Die Erstautorin (UM) hat keinen Interessenkonflikt, der Zweitautor (PE) hat einen Beratervertrag mit der Sponsor-Firma (SymbioPharm), der Drittautor (EZ) hat die Anwenderbeobachtung im Auftrag der Sponsor-Firma statistisch ausgewertet.
Literatur
[1] Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006;130(5):1480-91. DOI: 10.1053/j.gastro.2005.11.061[2] Rasquin A, Di Lorenzo C, Forbes D, Guiraldes E, Hyams JS, Staiano A, Walker LS. Childhood functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2006;130(5):1527-37. DOI: 10.1053/j.gastro.2005.08.063
[3] Hyman PE, Milla PJ, Benninga MA, Davidson GP, Fleisher DF, Taminiau J. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology. 2006;130(5):1519-26. DOI: 10.1053/j.gastro.2005.11.065
[4] Apley J, Naish N. Recurrent abdominal pains: a field survey of 1,000 school children. Arch Dis Child. 1958;33(168):165-70. DOI: 10.1136/adc.33.168.165
[5] Roth-Isigkeit A, Thyen U, Stöven H, Schwarzenberger J, Schmucker P. Pain among children and adolescents: restrictions in daily living and triggering factors. Pediatrics. 2005;115(2):e152-62. DOI: 10.1542/peds.2004-0682
[6] Ellert U, Neuhauser H, Roth-Isigkeit A. Schmerzen bei Kindern und Jugendlichen in Deutschland: Prävalenz und Inanspruchnahme medizinischer Leistungen Ergebnisse des Kinder-und Jugend-gesundheitssurveys (KiGGS) [Pain in children and adolescents in Germany: the prevalence and usage of medical services. Results of the German Health Interview and Examination Survey for Children and Adolescents (KiGGS)]. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz. 2007;50(5-6):711-7. DOI: 10.1007/s00103-007-0232-8
[7] Schwille IJ, Giel KE, Ellert U, Zipfel S, Enck P. A community-based survey of abdominal pain prevalence, characteristics, and health care use among children. Clin Gastroenterol Hepatol. 2009;7(10):1062-8. DOI: 10.1016/j.cgh.2009.07.002
[8] Hammerle CW, Surawicz CM. Updates on treatment of irritable bowel syndrome. World J Gastroenterol. 2008;14(17):2639-49. DOI: 10.3748/wjg.14.2639
[9] Caramia G. Metchnikoff and the centenary of probiotics: an update of their use in gastroenteric pathology during the age of development. Minerva Pediatr. 2008;60(6):1417-35.
[10] Krammer H, Neumer F, Enck P. Beeinflussung des Reizdarmsyndroms und der Obstipation durch Pro- und Präbiotika. In: Bischoff SC, editor. Probiotika, Präbiotika, Synbiotika. Stuttgart: Thieme Verlag; 2009. p. 232-42.
[11] Vlieger AM, Robroch A, van Buuren S, Kiers J, Rijkers G, Benninga MA, te Biesebeke R. Tolerance and safety of Lactobacillus paracasei ssp. paracasei in combination with Bifidobacterium animalis ssp. lactis in a prebiotic-containing infant formula: a randomised controlled trial. Br J Nutr. 2009;102(6):869-75. DOI: 10.1017/S0007114509289069
[12] Henker J, Blokhin BM, Bolbot YK, Maydannik VG. Akute Diarrhö bei Säuglingen und Kleinkindern. Erfolgreiche adjuvante Therapie mit dem probiotikum Mutaflor. Pädiat Prax. 2007/2008;71:605-610.
[13] Osborn DA, Sinn JK. Probiotics in infants for prevention of allergic disease and food hypersensitivity. Cochrane Database Syst Rev. 2007;(4):CD006475. DOI: 10.1002/14651858.CD006475.pub2
[14] Enck P, Zimmermann K, Menke G, Klosterhalfen S. Randomized controlled treatment trial of irritable bowel syndrome with a probiotic E.-coli preparation (DSM17252) compared to placebo. Z Gastroenterol. 2009;47(2):209-14. DOI: 10.1055/s-2008-1027702
[15] Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O'Mahony L, Kiely B, Shanahan F, Quigley EM. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006;101(7):1581-90. DOI: 10.1111/j.1572-0241.2006.00734.x
[16] Guyonnet D, Chassany O, Ducrotte P, Picard C, Mouret M, Mercier CH, Matuchansky C. Effect of a fermented milk containing Bifidobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care: a multicentre, randomized, double-blind,controlled trial. Aliment Pharmacol Ther. 2007;26(3):475-86. DOI: 10.1111/j.1365-2036.2007.03362.x
[17] Agrawal A, Houghton LA, Morris J, Reilly B, Guyonnet D, Goupil Feuillerat N, Schlumberger A, Jakob S, Whorwell PJ. Clinical trial: the effects of a fermented milk product containing Bifidobacterium lactis DN-173-010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation. Aliment Pharmacol Ther. 2009. In press.
[18] Nikfar S, Rahimi R, Rahimi F, Derakhshani S, Abdollahi M. Efficacy of probiotics in irritable bowel syndrome: a meta-analysis of randomized, controlled trials. Dis Colon Rectum. 2008;51(12):1775-80. DOI: 10.1007/s10350-008-9335-z
[19] McFarland LV, Dublin S. Meta-analysis of probiotics for the treatment of irritable bowel syndrome. World J Gastroenterol. 2008;14(17):2650-61. DOI: 10.3748/wjg.14.2650
[20] Hoveyda N, Heneghan C, Mahtani KR, Perera R, Roberts N, Glasziou P. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterol. 2009;9:15. DOI: 10.1186/1471-230X-9-15
[21] Haller D, Rijkers GT, Bengmark S, Enck P, Lenoir-Wijnkoop I, Antoine JM. Guidance for substantiating the evidence of the probiotics beneficial effects: Probiotics in chronic intestinal inflammatory and functional disorders. J Nutrition. In press.
[22] Bausserman M, Michail S. The use of Lactobacillus GG in irritable bowel syndrome in children: a double-blind randomized control trial. J Pediatr. 2005;147(2):197-201. DOI: 10.1016/j.jpeds.2005.05.015
[23] Gawronska A, Dziechciarz P, Horvath A, Szajewska H. A randomized double-blind placebo-controlled trial of Lactobacillus GG for abdominal pain disorders in children. Aliment Pharmacol Ther. 2007;25(2):177-84. DOI: 10.1111/j.1365-2036.2006.03175.x
[24] Vandenplas Y, Benninga M. Probiotics and functional gastrointestinal disorders in children. J Pediatr Gastroenterol Nutr. 2009;48(Suppl 2):S107-9. DOI: 10.1097/MPG.0b013e3181a1603a
[25] Huertas-Ceballos AA, Logan S, Bennett C, Macarthur C. Dietary interventions for recurrent abdominal pain (RAP) and irritable bowel syndrome (IBS) in childhood. Cochrane Database Syst Rev. 2009;(1):CD003019. DOI: 10.1002/14651858.CD003019.pub3
[26] Enck P, Zimmermann K, Menke G, Müller-Lissner S, Martens U, Klosterhalfen S. A mixture of E.coli (DSM17252) and Enterococcus faecalis (DSM16440) for treatment of the irritable bowel syndrome - a randomized controlled trial with primary care physicians. Neurogastroenterol Motil. 2008;20:1103-9. DOI: 10.1111/j.1365-2982.2008.01156.x
[27] Cremonini F, Talley NJ. Irritable bowel syndrome: epidemiology, natural history, health care seeking and emerging risk factors. Gastroenterol Clin North Am. 2005;34(2):189-204. DOI: 10.1016/j.gtc.2005.02.008
[28] Enck P, Klosterhalfen S. The placebo response in functional bowel disorders: perspectives and putative mechanisms. Neurogastroenterol Motil. 2005;17(3):325-31. DOI: 10.1111/j.1365-2982.2005.00676.x
[29] Design of Treatment Trials Committee, Irvine EJ, Whitehead WE, Chey WD, Matsueda K, Shaw M, Talley NJ, Veldhuyzen van Zanten SJ. Design of treatment trials for functional gastrointestinal disorders. Gastroenterology. 2006;130(5):1538-51. DOI: 10.1053/j.gastro.2005.11.058




