[Wassergefiltertes Infrarot A (wIRA) bei akuten und chronischen Wunden]
Gerd Hoffmann 11 Johann Wolfgang Goethe-Universität Frankfurt am Main, Institut für Sportwissenschaften, Frankfurt am Main, Deutschland
Zusammenfassung
Wassergefiltertes Infrarot A (wIRA) als spezielle Form der Wärmestrahlung mit hohem Eindringvermögen in das Gewebe bei geringer thermischer Oberflächenbelastung kann die Heilung akuter und chronischer Wunden sowohl über thermische und temperaturabhängige als auch über nicht-thermische und temperaturunabhängige Effekte verbessern. wIRA steigert Temperatur (+2,7°C in 2 cm Gewebetiefe) und Sauerstoffpartialdruck im Gewebe (+32% in 2 cm Gewebetiefe) sowie die Gewebedurchblutung. Diese drei Faktoren sind entscheidend für eine ausreichende Versorgung des Gewebes mit Energie und Sauerstoff und deshalb auch für Wundheilung und Infektionsabwehr.
wIRA vermag Schmerzen deutlich zu mindern (ausnahmslos bei 230 Bestrahlungen) mit bemerkenswert niedrigerem Analgetikabedarf (52–69% niedriger in den Gruppen mit wIRA verglichen mit den Kontrollgruppen) und eine erhöhte Wundsekretion und Entzündung herabzusetzen sowie positive immunmodulierende Effekte zu zeigen. Die Gesamtbeurteilung des Effekts der Bestrahlung wie auch die Wundheilung und das kosmetische Ergebnis (erhoben mittels visueller Analogskalen) waren in der Gruppe mit wIRA wesentlich besser verglichen mit der Kontrollgruppe. wIRA kann sowohl bei akuten als auch bei chronischen Wunden einschließlich infizierter Wunden die Wundheilung beschleunigen (Abnahme der Wundfläche im Median um 90% bei schwerbrandverletzten Kindern bereits nach 9 Tagen in der Gruppe mit wIRA verglichen mit 13 Tagen in der Kontrollgruppe; im Durchschnitt 18 versus 42 Tage bis zum kompletten Wundschluss bei chronischen venösen Unterschenkelulzera) oder bei stagnierender Wundheilung verbessern (mit Erreichen eines kompletten Wundschlusses und Normalisierung des thermographischen Bildes bei zuvor therapierefraktären chronischen venösen Unterschenkelulzera). Nach großen abdominalen Operationen zeigte sich ein Trend zugunsten der wIRA-Gruppe hin zu einer niedrigeren Rate von Wundinfektionen insgesamt (7% versus 15%) einschließlich später Infektionen nach der Entlassung aus dem Krankenhaus (0% versus 8%) und ein Trend hin zu einem kürzeren postoperativen Krankenhausaufenthalt (9 versus 11 Tage).
Selbst der normale Wundheilungsprozess kann verbessert werden.
Die erwähnten Effekte wurden in 6 prospektiven Studien belegt, die meisten mit einem Evidenzgrad von Ia/Ib.
wIRA stellt eine wertvolle Therapieoption dar und kann generell für die Therapie von akuten und chronischen Wunden empfohlen werden.
Schlüsselwörter
wassergefiltertes Infrarot A (wIRA), Infrarot-A-Strahlung, Wundheilung, thermische und nicht-thermische Effekte, temperaturabhängige und temperaturunabhängige Effekte, Energiebereitstellung, Sauerstoffversorgung, Sauerstoffpartialdruck im Gewebe, Gewebetemperatur, Gewebedurchblutung, Schmerzminderung, Wundsekretion, Entzündung, immunmodulierende Effekte, akute Wunden, chronische Wunden, chronische venöse Unterschenkel-Ulzera, Problemwunden, Wundinfektionen, Infektionsabwehr, kontaktfreies, verbrauchsmaterialfreies Verfahren, prospektive, randomisierte, kontrollierte, doppeltblinde Studien, visuelle Analogskalen (VAS), Lebensqualität, Infrarot-Thermographie, thermographische Bildanalyse
Einleitung
Die Anwendung von wassergefiltertem Infrarot A (wIRA) zur Verbesserung der Wundheilung bei akuten und chronischen Wunden einschließlich der Grundlagen wird ausführlicher als hier in den drei zusammengehörigen Übersichtsarbeiten [1], [2], [3] (insgesamt 42 PDF-Seiten) beschrieben. Bitte ziehen Sie diese Übersichtsarbeiten für weitere Details und Literaturangaben heran. Daneben existieren zwei weitere Übersichtsarbeiten zu diesem Themenbereich [4], [5] sowie eine thematisch etwas breiter angelegte Übersichtsarbeit [6].
Wirkprinzipien von wIRA
Die Erfahrung der angenehmen Wärme der Sonne in gemäßigten Breiten entsteht durch die Filterung der Wärmestrahlung der Sonne durch Wasserdampf in der Erdatmosphäre [1], [4], [5], [6], [7], [8], siehe Abbildung 1 [Abb. 1]. Durch die Wasserfilterung werden die Strahlungsanteile gemindert (sogenannte Wasserbanden innerhalb des Infrarot A sowie die meisten Teile des Infrarot B und C), die sonst durch Wechselwirkung mit Wassermolekülen in der Haut eine unerwünschte thermische Belastung der obersten Hautschicht hervorrufen würden [1], [4], [5], [6], [7], [8]. Technisch wird wassergefiltertes Infrarot A (wIRA) in speziellen Strahlern erzeugt, in denen die gesamte Strahlung eines Halogen-Strahlers durch eine Wasser enthaltende Küvette hindurchtritt, so dass die genannten unerwünschten Strahlungsanteile innerhalb des Infrarot gemindert oder herausgefiltert werden [1], [9], siehe Abbildung 2 [Abb. 2]. Innerhalb des Infrarot stellt das verbleibende wIRA (im Bereich 780–1400 nm) vorwiegend Strahlung mit gutem Eindringvermögen in das Gewebe dar und erlaubt gegenüber ungefilterter Infrarotstrahlung einen mehrfachen Energieeintrag in das Gewebe ohne die Haut zu reizen, vergleichbar der Sonnenwärmestrahlung in gemäßigten Breiten. Typische wIRA-Strahler emittieren keine Ultraviolett-Strahlung (UV) und nahezu keine Infrarot-B- und Infrarot-C-Strahlung, und der Anteil der Infrarot-A-Strahlung ist im Verhältnis zum Anteil des sichtbaren Lichts (380–780 nm) betont [1], [9], siehe Abbildung 3 [Abb. 3].
Abbildung 1: Spektrale Bestrahlungsstärke der Sonne außerhalb der Atmosphäre und auf der Erdoberfläche auf Meereshöhe, in beiden Fällen mit der Sonne am Zenit und für einen mittleren Erde-Sonne-Abstand. Die schattierten Flächen zeigen die Absorption aufgrund der angegebenen Bestandteile der Atmosphäre bis zum Erreichen der Erdoberfläche auf Meereshöhe (aus [1], [58], adaptiert aus [59]). Für den Vergleich der Abbildungen 1 und 3: 1000 W · m–2 · µm–1 = 100 mW · cm–2 · µm–1 = 1 mW · cm–2 · (10 nm)–1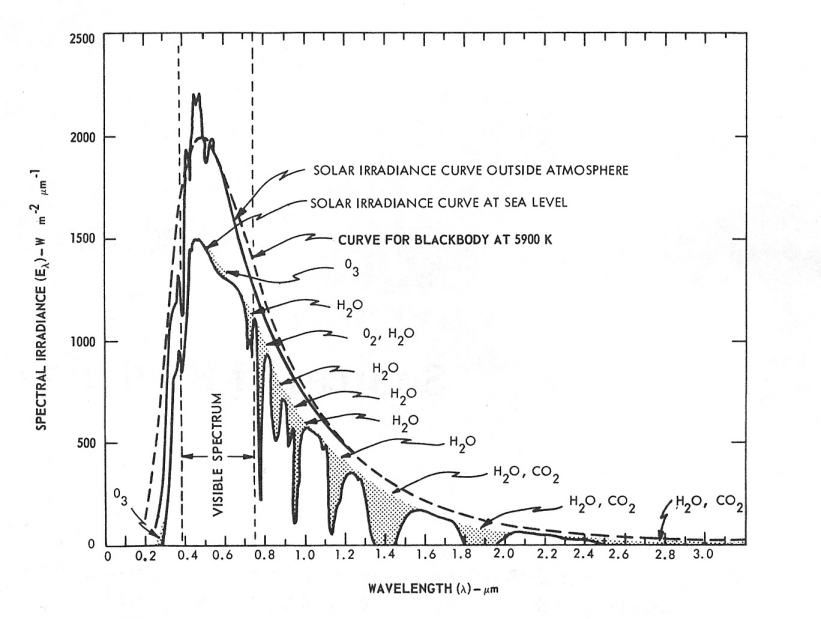
Abbildung 2: Querschnitt eines wassergefilterten Infrarot-A-Strahlers (Hydrosun, Müllheim, Deutschland)
Die gesamte inkohärente nicht-polarisierte Breitband-Strahlung einer 3000-Kelvin-Halogen-Lampe tritt durch eine Küvette, die Wasser enthält, das die unerwünschten Wellenlängen innerhalb des Infrarot mindert oder herausfiltert (die meisten Teile des Infrarot B und C und die Wasserabsorptionsbanden innerhalb des Infrarot A). Das Wasser ist hermetisch in der Küvette eingeschlossen. Ein Lüfter kühlt die Küvette per Luftstrom und verhindert so ein Kochen des Wassers. (adaptiert aus [1])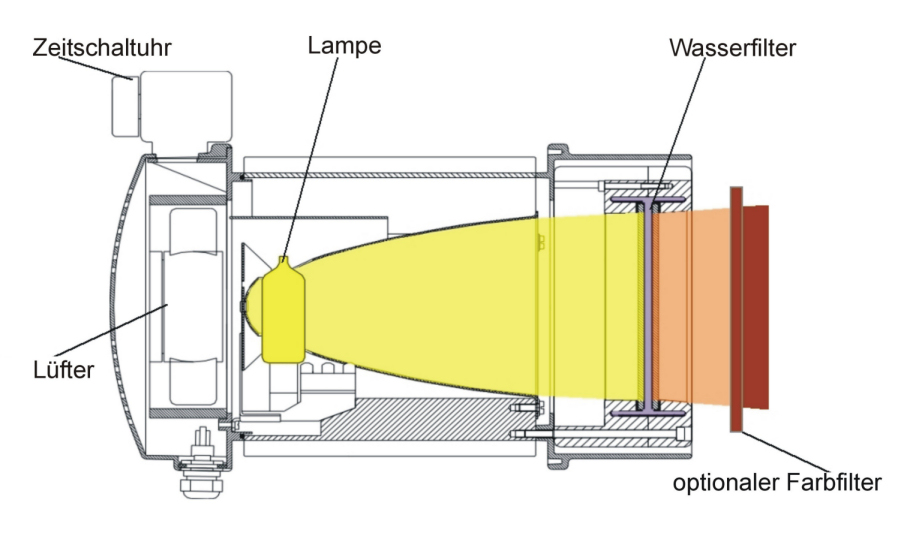
Abbildung 3: Vergleich der Spektren der Sonne auf der Erdoberfläche auf Meereshöhe und des Spektrums eines wIRA-Strahlers.
Spektrale Bestrahlungsstärke der Sonne auf der Erdoberfläche auf Meereshöhe (mit der Sonne am Zenith und bei mittlerem Erde-Sonne-Abstand) (aus [1], adaptiert aus [58]) und spektrale Bestrahlungsstärke eines wIRA-Strahlers (Hydrosun®-Strahler 501 mit 10 mm Wasserküvette und Orangefilter OG590) bei ca. 210 mW/cm² (= 2,1 · 10³ W/m²) Gesamtbestrahlungsstärke (adaptiert aus [1], [4]). Das Spektrum der Sonne auf Meereshöhe umfasst Ultraviolett-Strahlung (UV, <400 nm), sichtbares Licht (VIS, 380–780 nm) und Infrarotstrahlung (IR, >780 nm). Das Spektrum des wIRA-Strahlers umfasst nur sichtbares Licht (VIS) und Infrarotstrahlung (IR); der sichtbare Teil hängt vom verwendeten Farbfilter ab; der wIRA-Strahler emittiert keine Ultraviolett-Strahlung (UV). Beide Spektren zeigen die verminderten Bestrahlungsstärken im Bereich der Wasserabsorptionsbanden.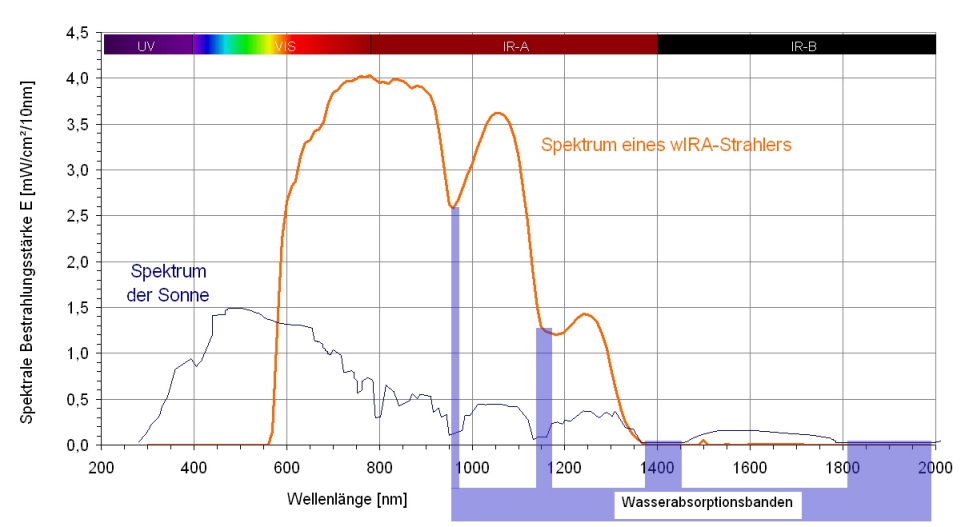
Innerhalb des Spektrums von Infrarot-A- und wassergefilterter Infrarot-A-Strahlung wurden Effekte insbesondere von den energiereichen Wellenlängen nahe dem sichtbaren Licht – ungefähr 780–1000 nm (800–900 nm [10], [11], [12], 800 nm [13], 820 nm [14], [15], [16], 830 nm [17]) – sowohl in vitro als auch in vivo beschrieben; diese Wellenlängen scheinen den klinisch wichtigsten Teil von Infrarot A und wIRA darzustellen [1], [18].
Wassergefiltertes Infrarot A als spezielle Form der Wärmestrahlung mit hohem Eindringvermögen in das Gewebe bei geringer thermischer Oberflächenbelastung, siehe Abbildung 4 [Abb. 4], wirkt sowohl über thermische (auf Wärmeenergietransfer bezogene) und temperaturabhängige (mit Temperaturänderung auftretende) als auch über nicht-thermische (ohne relevanten Wärmeenergietransfer) und temperaturunabhängige (ohne relevante Temperaturänderung auftretende) Effekte [1]. wIRA erzeugt ein therapeutisch nutzbares Wärmefeld im Gewebe und steigert Temperatur [19], [20], [21], [22], [23], [24], [25], [26] und Sauerstoffpartialdruck im Gewebe [19] sowie die Gewebedurchblutung [1], [24], [25], [26], drei entscheidende Faktoren für eine ausreichende Versorgung des Gewebes mit Energie und Sauerstoff.
Abbildung 4: Vergleich von Bestrahlungen mit wassergefiltertem Infrarot A und mit konventionellem Infrarot
Thermographischer Vergleich der Hautoberflächentemperaturen in der Lendenregion 12 Minuten nach Beginn der Bestrahlungen mit wassergefiltertem Infrarot A (links) und mit konventionellem Infrarot (rechts) mit der gleichen Bestrahlungsstärke: die Hautoberflächentemperatur ist bei Bestrahlung mit konventionellem Infrarot höher (wie in der Thermographie dargestellt), während die Temperatur in 1 cm Gewebetiefe bei Bestrahlung mit wassergefiltertem Infrarot A höher ist (aus [1], [20]). So weist wassergefiltertes Infrarot A ein hohes Eindringvermögen in das Gewebe bei geringer thermischer Oberflächenbelastung auf. 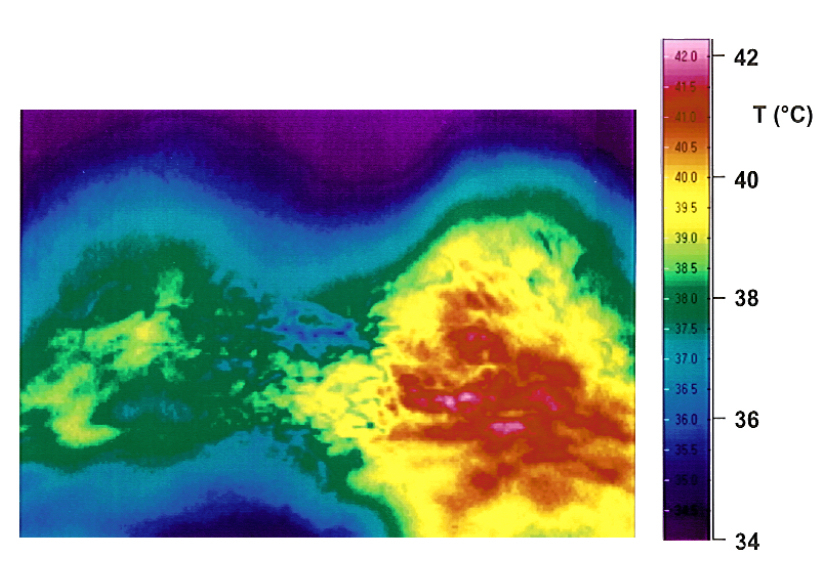
Da Wundheilung und Infektionsabwehr (z.B. Granulozytenfunktion einschließlich ihrer antibakteriellen Sauerstoffradikalbildung) entscheidend von einer ausreichenden Versorgung mit Energie und Sauerstoff abhängen und das Zentrum chronischer Wunden häufig relativ hypotherm ist [1], [19], [23] (während z.B. sowohl präoperative [27] als auch postoperative [19], [28] Wärmezufuhr zum Operationsgebiet die Wundheilung von Operationswunden verbessern kann) und häufig einen Sauerstoffpartialdruck nahe Null hat [1], [19], [23], [29], [30], [31], [32], [33], [34], [35], [36], [37], [38], stellt die Verbesserung sowohl der Energiebereitstellung pro Zeit (Steigerung der Stoffwechselleistung) als auch der Sauerstoffversorgung eine Erklärung für die klinisch gute Wirkung von wIRA auf Wunden und Wundinfektionen dar [1]. Zusätzlich hat wIRA nicht-thermische und ohne relevante Temperaturänderung auftretende Effekte, die darauf beruhen, direkte Reize auf Zellen und zelluläre Strukturen zu setzen: Reaktionen der Zellen auf Infrarot – auch z.T. bei sehr kleinen Bestrahlungsintensitäten – sind z.B. zielgerichtetes Plasmodienwachstum [10], Beeinflussung der Cytochrom-c-Oxidase [14], [39], [40], zielgerichtetes Wachstum von Neuronen [13], Stimulation der Wundheilung [41], [42] sowie zellschützende Effekte von Infrarot A [43], [44], [45], [46] und wassergefiltertem Infrarot A (wIRA) [47], [48], [49].
wIRA vermag Schmerzen deutlich zu mindern (mit bemerkenswert niedrigerem Analgetikabedarf) und eine erhöhte Wundsekretion und Entzündung herabzusetzen sowie positive immunmodulierende Effekte zu zeigen. wIRA kann sowohl bei akuten als auch bei chronischen Wunden einschließlich infizierter Wunden die Wundheilung beschleunigen oder bei stagnierender Wundheilung verbessern. Selbst der normale Wundheilungsprozess kann verbessert werden [1], [19].
wIRA ist ein kontaktfreies, verbrauchsmaterialfreies, leicht anzuwendendes, als angenehm empfundenes Verfahren mit guter Tiefenwirkung. Für wIRA mit angemessenen therapeutischen Bestrahlungsstärken und -dosen konnte nicht nur gezeigt werden, dass es für menschliche Haut unbedenklich ist [1], [4], [18], [47], [48], [50], sondern dass es zellschützende Effekte gegen UV-bedingte Schäden hat [1], [4], [43], [44], [45], [46], [47], [48], [49]. Sicherheitsaspekte der klinischen Anwendung von wIRA werden ausführlich in [1] und [18] beschrieben. Insbesondere auch unter Berücksichtigung von [50] sowie der aktuellen Übersichtsarbeit [51] ist die Anwendung von wIRA mit adäquaten Bestrahlungsstärken als sicher anzusehen. Die Bestrahlung der typischerweise unbedeckten Wunde erfolgt mit einem wIRA-Strahler, siehe Abbildung 5 [Abb. 5].
Abbildung 5: Beispiel für eine Bestrahlung einer Wunde mit einem wassergefilterten Infrarot-A-Strahler
(veröffentlicht mit freundlicher Genehmigung von Prof. James Mercer, Tromsø/Norwegen) (aus [1], [23])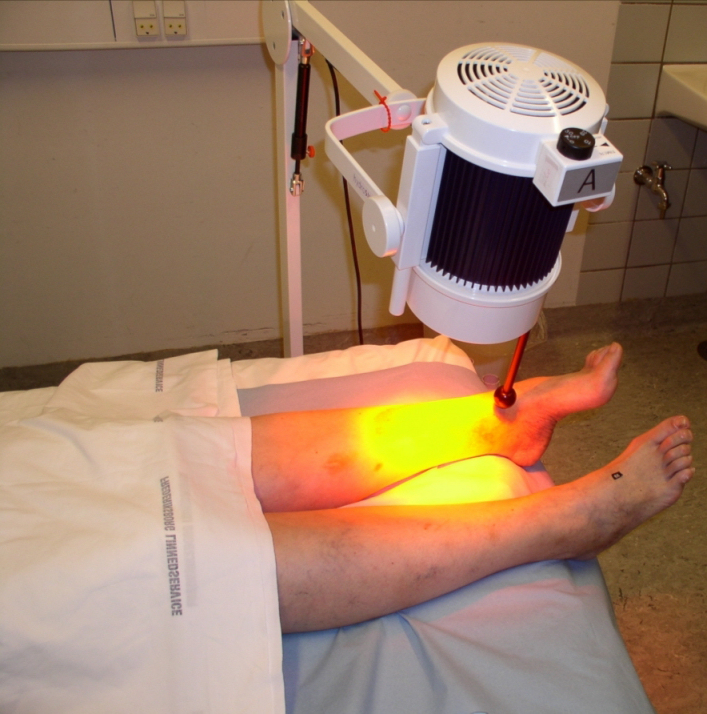
Klinische Wirkungen von wIRA bei Wunden
Aufgrund von 6 klinischen Studien sind mit Evidenzgrad Ia/Ib belegt [1], [52]:
- akute Schmerzminderung während einer wIRA-Bestrahlung
- Minderung der erforderlichen Schmerzmedikation
- größere/schnellere Wundflächenreduktion
- bessere Gesamteinschätzung der Wundheilung
- bessere Gesamteinschätzung des Effekts der Therapie (Schmerzen, Wundheilung, Kosmetik)
- höherer Gewebesauerstoffpartialdruck während wIRA
- höhere subkutane Gewebetemperatur während wIRA
- besserer kosmetischer Aspekt
Als Trend wurden außerdem gefunden:
- niedrigere Wundinfektionsrate
- kürzerer Krankenhausaufenthalt
Weitere klinische Beobachtungen sind:
- Entzündungsminderung
- Hypersekretionsminderung
Therapie akuter Wunden mit wIRA
wIRA für akute Operationswunden (Studie der Universitätsklinik Heidelberg, Klinik für Chirurgie)
Eine prospektive, randomisierte, kontrollierte, doppeltblinde Studie mit 111 Patienten nach großen abdominalen Operationen in der Chirurgischen Universitätsklinik Heidelberg in Deutschland zeigte mit 20 Minuten Bestrahlung zweimal am Tag (beginnend am zweiten postoperativen Tag) in der Gruppe mit wIRA und sichtbarem Licht VIS (wIRA(+VIS), ungefähr 75% wIRA, 25% VIS) verglichen mit der Kontrollgruppe mit nur VIS eine signifikante und relevante Schmerzminderung verbunden mit einer deutlich verminderten erforderlichen Analgetikadosis: während 230 einzelner Bestrahlungen mit wIRA(+VIS) nahm der Schmerz ausnahmslos ab (der Median der Schmerzminderung an den postoperativen Tagen 2–6 betrug 13,4 auf einer 100 mm visuellen Analogskala VAS 0–100), während der Schmerz in der Kontrollgruppe unverändert blieb (p<0,000001, siehe Abbildung 6 [Abb. 6]). Der Median der Schmerzminderung am dritten postoperativen Tag betrug 18,5 versus 0,0, die mediane Differenz zwischen den Gruppen 18,4 (99%-Konfidenzintervall 12,3/21,0), p<0,000001. (Semantische statistische Anmerkung in [2], [5].)
Abbildung 6: Abnahme der postoperativen Schmerzen während Bestrahlung in der Gruppe mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) und in der Kontrollgruppe mit nur sichtbarem Licht (VIS) (Studie Heidelberg)
(erhoben mit einer visuellen Analogskala; dargestellt mit Minimum, 25%-Perzentile, Median, 75%-Perzentile und Maximum (Box-Whiskers-Darstellung; die Box repräsentiert die Interquartil-Spanne), adaptiert aus [2], [19]). Der Schmerz nahm während der 230 einzelnen Bestrahlungen mit wIRA(+VIS) ausnahmslos ab, während der Schmerz in der Kontrollgruppe unverändert blieb (p<0,000001 für jeden einzelnen dargestellten Tag wie auch für die Gesamtheit der Tage).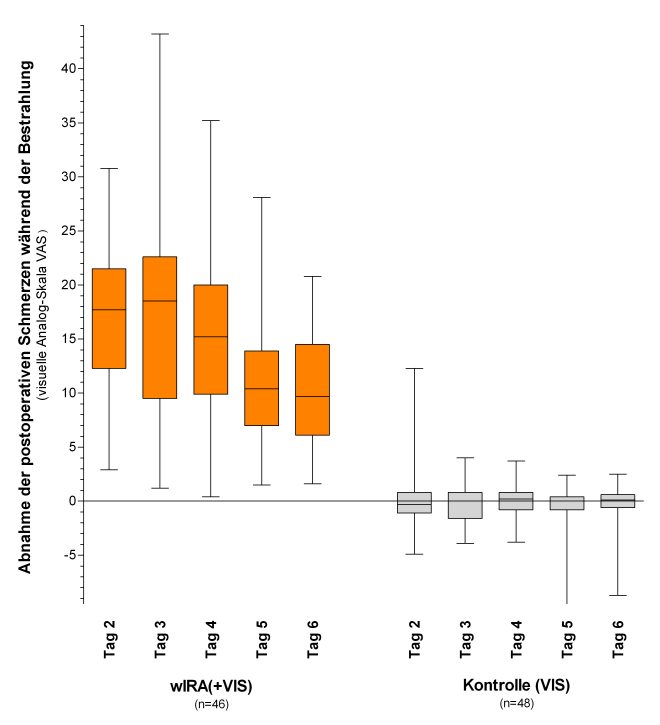
Die erforderliche Analgetikadosis war in den Untergruppen mit wIRA(+VIS) 52–69% niedriger (mediane Differenzen) im Vergleich zu den Kontrolluntergruppen mit nur VIS (Median 598 versus 1398 ml Ropivacain, p=0,000020, für Peridural-Katheter-Analgesie; 31 versus 102 mg Piritramid, p=0,00037, für patientenkontrollierte Analgesie; 3,4 versus 10,2 g Metamizol, p=0,0045, für intravenöse und orale Analgesie, siehe Abbildung 7 [Abb. 7]).
Abbildung 7: Erforderliche Analgetikadosis in den Untergruppen mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) im Verhältnis zu den Kontrolluntergruppen mit nur sichtbarem Licht (VIS) (Mediane der Kontrolluntergruppen = 100) (Studie Heidelberg)
(dargestellt mit Minimum, 25%-Perzentile, Median, 75%-Perzentile und Maximum (Box-Whiskers-Darstellung; die Box repräsentiert die Interquartil-Spanne), adaptiert aus [2], Daten aus [19]). Die erforderliche Analgetikadosis war in den Untergruppen mit wIRA(+VIS) 52–69% niedriger (mediane Differenzen) im Vergleich zu den Kontrolluntergruppen mit nur VIS.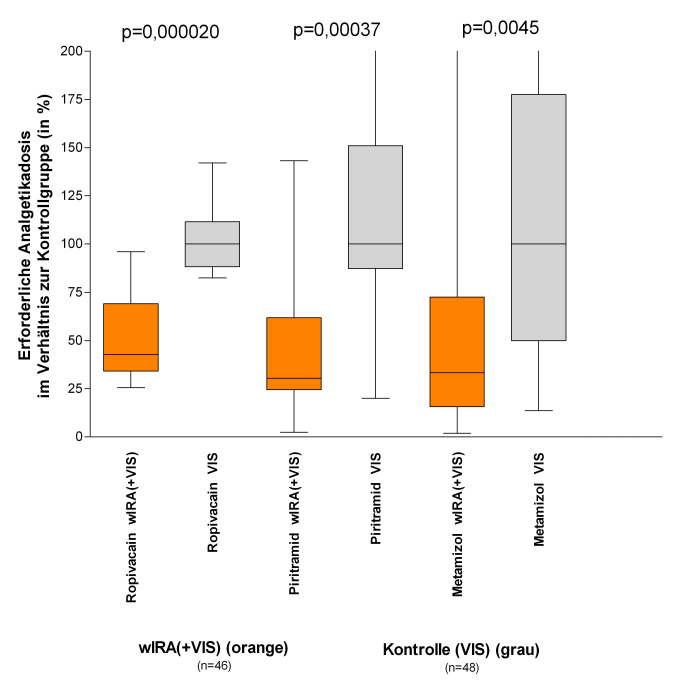
Während der Bestrahlung mit wIRA(+VIS) stieg der subkutane Sauerstoffpartialdruck wesentlich um 32% und die subkutane Temperatur um 2,7°C an (beides in 2 cm Gewebetiefe), während beide in der Kontrollgruppe unverändert blieben. Nach Bestrahlung lag der Median des subkutanen Sauerstoffpartialdrucks bei 41,6 (mit wIRA) versus 30,2 mm Hg in der Kontrollgruppe (mediane Differenz zwischen den Gruppen 11,9 mm Hg (+39%), 99%-Konfidenzintervall 8,4/15,4 mm Hg (+28%/+51%), p<0,000001, siehe Abbildung 8 [Abb. 8]) und der Median der subkutanen Temperatur bei 38,9 versus 36,4°C (mediane Differenz zwischen den Gruppen 2,6°C, 99%-Konfidenzintervall 2,1/2,9°C, p<0,000001, siehe Abbildung 9 [Abb. 9]). Die Ruhewerte (vor Bestrahlung) des subkutanen Sauerstoffpartialdrucks stiegen vom 2. zum 10. postoperativen Tag um 3,4 versus 0,3 mm Hg (mediane Differenz zwischen den Gruppen 3,1 mm Hg (+10%), 99%-Konfidenzintervall 1,9/3,7 mm Hg, p=0,00051). Die Ruhewerte der subkutanen Temperatur stiegen um 0,4 versus –0,3°C (mediane Differenz 0,6°C, 95%-Konfidenzintervall 0,2/0,8°C, p=0,0074) (Effekte, die über den Zeitraum der einzelnen Bestrahlung hinausreichen).
Abbildung 8: Subkutaner Sauerstoffpartialdruck in 2 cm Gewebetiefe an den postoperativen Tagen 2 und 10 in der Gruppe mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) und in der Kontrollgruppe mit nur sichtbarem Licht (VIS) (Studie Heidelberg)
(dargestellt mit Minimum, 25%-Perzentile, Median, 75%-Perzentile und Maximum (Box-Whiskers-Darstellung; die Box repräsentiert die Interquartil-Spanne); adaptiert aus [2], [19]). Während der Bestrahlung mit wIRA(+VIS) stieg der subkutane Sauerstoffpartialdruck deutlich um mehr als 30% an, während er in der Kontrollgruppe unverändert blieb. 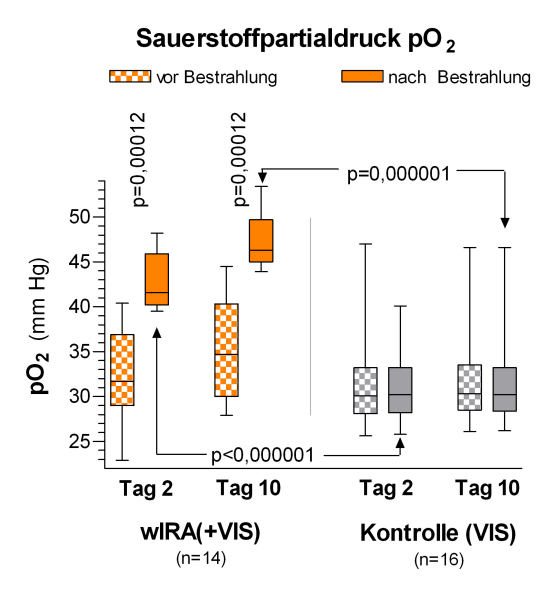
Abbildung 9: Subkutane Temperatur in 2 cm Gewebetiefe an den postoperativen Tagen 2 und 10 in der Gruppe mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) und in der Kontrollgruppe mit nur sichtbarem Licht (VIS) (Studie Heidelberg)
(dargestellt mit Minimum, 25%-Perzentile, Median, 75%-Perzentile und Maximum (Box-Whiskers-Darstellung; die Box repräsentiert die Interquartil-Spanne); adaptiert aus [2], [19]). Während der Bestrahlung mit wIRA(+VIS) stieg die subkutane Temperatur deutlich um ungefähr 2,7°C an, während sie in der Kontrollgruppe unverändert blieb.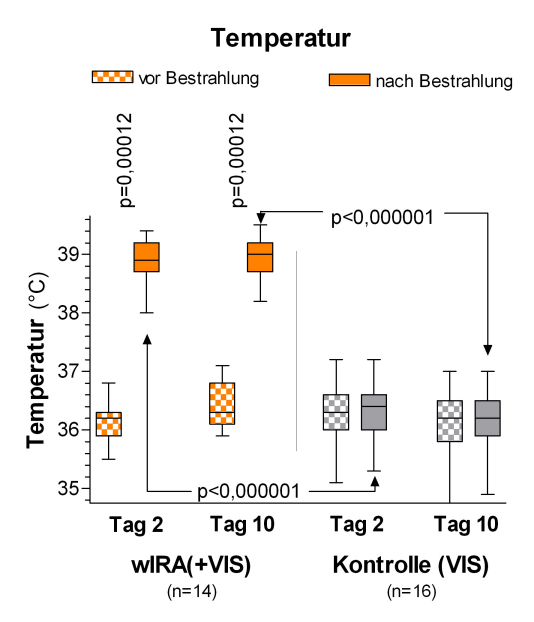
Die Gesamtbeurteilung des Effekts der Bestrahlung einschließlich Wundheilung, Schmerzen und kosmetischem Ergebnis, erhoben mit einer VAS (0–100 mit 50 als Indifferenzpunkt ohne Effekt) durch den Chirurgen (Median 79,0 versus 46,8, mediane Differenz 27,9, 99%-Konfidenzintervall 17,2/37,3, p<0,000001) oder den Patienten (79,0 versus 50,2, mediane Differenz 23,8, 99%-Konfidenzintervall 9,5/34,1, p=0,000007), war in der Gruppe mit wIRA wesentlich besser verglichen mit der Kontrollgruppe. Das galt auch für die einzelnen Aspekte, d.h. Wundheilung, erhoben mit einer VAS durch den Chirurgen (Median 88,6 versus 78,5, p<0,000001) oder den Patienten (Median 85,8 versus 81,0, p=0,040, Trend), und kosmetisches Ergebnis, erhoben mit einer VAS durch den Chirurgen (Median 84,5 versus 76,5, p=0,00027) oder den Patienten (Median 86,7 versus 73,6, p=0,00077).
Außerdem zeigte sich ein Trend zugunsten der wIRA-Gruppe hin zu einer niedrigeren Rate von Wundinfektionen insgesamt (3 von 46, 7%, versus 7 von 48, 15%, Differenz –8%, 95%-Konfidenzintervall –20%/4%, p=0,21) einschließlich später Infektionen nach der Entlassung, hervorgerufen durch eine unterschiedliche Rate später Infektionen nach der Entlassung mit 0 von 46 (0%) in der wIRA-Gruppe und 4 von 48 (8%) in der Kontrollgruppe (Differenz –8%, 95%-Konfidenzintervall –18%/2%, p=0,12). Und es gab einen Trend hin zu einem kürzeren postoperativen Krankenhausaufenthalt mit 9 Tagen in der wIRA-Gruppe versus 11 Tagen in der Kontrollgruppe (mediane Differenz –2 Tage (–18%), 95%-Konfidenzintervall –3/0 Tage, p=0,022).
Das Hauptergebnis der Studie war, dass postoperative Bestrahlung mit wIRA selbst den normalen Wundheilungsprozess verbessern kann [2], [19].
wIRA für schwerbrandverletzte Kinder (Studie des Kinderkrankenhauses Park Schönfeld, Kassel, Klinik für Kinderchirurgie)
Eine prospektive, randomisierte, kontrollierte, doppelt-blinde Studie mit 45 schwerbrandverletzten Kindern im Kinderkrankenhaus Park Schönfeld, Kassel, Deutschland, zeigte mit täglich 30 Minuten Bestrahlung (ab dem ersten Tag, Tag der Verbrennung als Tag 1) in der Gruppe mit wIRA und sichtbarem Licht VIS (wIRA(+VIS), ungefähr 75% wIRA, 25% VIS) verglichen mit der Kontrollgruppe nur mit VIS eine deutlich schnellere Abnahme der Wundfläche. Am fünften Tag (nach 4 Tagen mit Bestrahlung) wurde entschieden, ob ein chirurgisches Debridement nekrotischen Gewebes wegen tieferer (Grad 2b) Verbrennungen notwendig war (11 von 21 in der Gruppe mit wIRA, 14 von 24 in der Kontrollgruppe) oder eine konservative Behandlung möglich war (Verbrennungen vom Grad 2a). Die Patienten mit konservativer Behandlung wurden in der Studie weitergeführt und bis zur vollständigen Reepithelisierung bestrahlt.
Die Patienten in der Gruppe mit wIRA zeigten eine deutlich schnellere Abnahme der Wundfläche: eine Abnahme der Wundfläche im Median um 50% wurde bereits nach 7 Tagen verglichen mit 9 Tagen in der Kontrollgruppe und eine Abnahme der Wundfläche im Median um 90% wurde nach 9 Tagen verglichen mit 13 Tagen in der Kontrollgruppe erreicht, siehe Abbildung 10 [Abb. 10] und Abbildung 11 [Abb. 11]. Nach 9 Tagen betrug der Median der Wundflächenabnahme 89,2% versus 49,5%, die mediane Differenz zwischen den Gruppen 39,5% Wundflächenabnahme (99%-Konfidenzintervall 34,4%/43,0%), p=0,000011. Die mediane Differenz zwischen den Gruppen bestand bereits nach einem Tag mit p=0,00013 und nach 2, 5, 6, 7, 8, 9, 10 und 11 Tagen mit p<0,0001. Außerdem zeigte die Gruppe mit wIRA bessere Ergebnisse hinsichtlich der chirurgischen Gesamteinschätzung der Wunde und hinsichtlich der Einschätzung des Effekts der Bestrahlung (letzteres als Trend bis 3 Monate nach der Verbrennung) verglichen mit der Kontrollgruppe [2].
Abbildung 10: Relative Änderung der Wundfläche von schwerbrandverletzten Kindern in Abhängigkeit von der Dauer der Behandlung (in Tagen) in der Gruppe mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) und in der Kontrollgruppe mit nur sichtbarem Licht (VIS) (Studie Kassel)
(dargestellt mit Minimum, 25%-Perzentile, Median, 75%-Perzentile und Maximum (Box-Whiskers-Darstellung; die Box repräsentiert die Interquartil-Spanne), adaptiert aus [2]). Die Abbildung präsentiert die Daten von den 10+10 = 20 Kindern (von 21+24 = 45 Kindern), die Verbrennungen vom Grad 2a (nicht 2b) hatten und die folglich bis zum kompletten Wundschluss konservativ einschließlich Bestrahlung (beginnend am Tag der Verbrennung bis zum kompletten Wundschluss) mit wIRA(+VIS) oder nur mit VIS (Kontrollgruppe) behandelt wurden. Patienten in der Gruppe mit wIRA zeigten eine deutlich schnellere Abnahme der Wundfläche verglichen mit der Kontrollgruppe: eine Abnahme der Wundfläche im Median um 50% wurde in der Gruppe mit wIRA bereits nach 7 Tagen verglichen mit 9 Tagen in der Kontrollgruppe und eine Abnahme der Wundfläche im Median um 90% wurde in der Gruppe mit wIRA bereits nach 9 Tagen verglichen mit 13 Tagen in der Kontrollgruppe erreicht.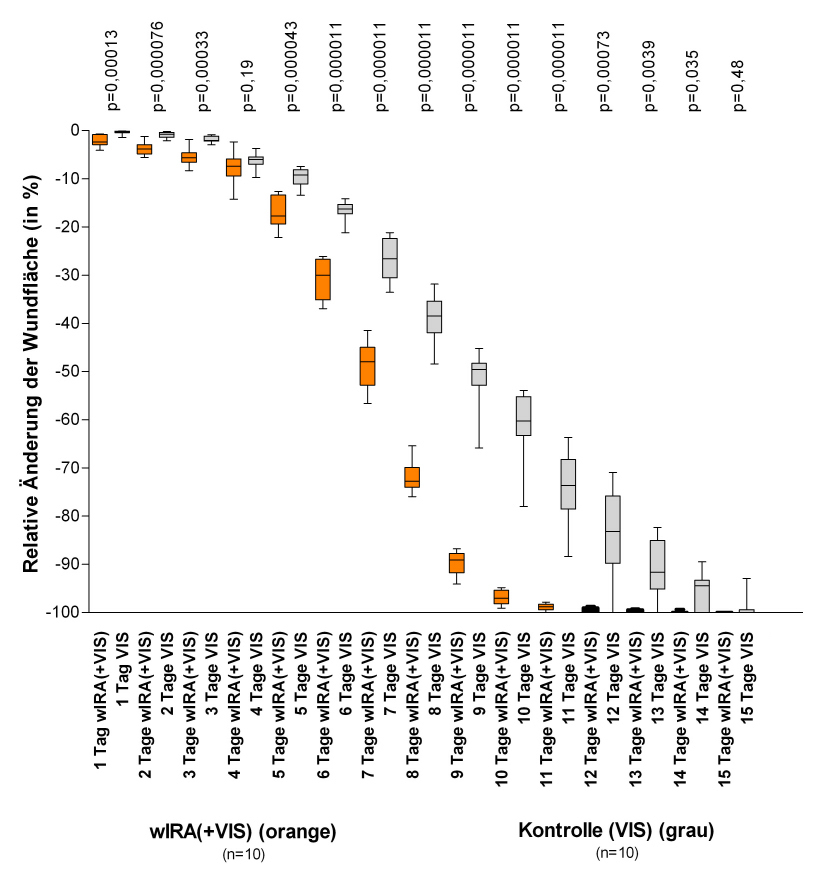
Abbildung 11: Beispiel für eine schnelle Besserung mit wIRA bei einem schwerbrandverletzten Kind (Studie Kassel)
Links: 1 Tag nach der Verbrennung, rechts: nur 30 Stunden später als auf dem linken Bild (aus [2]).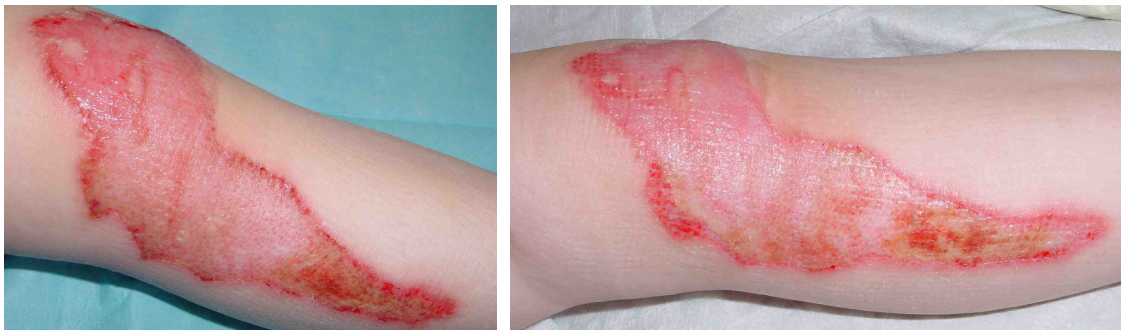
wIRA für experimentelle Wunden (Studie der Universitätsmedizin Charité Berlin, Klinik für Dermatologie)
In einer prospektiven, randomisierten, kontrollierten Studie mit 12 Probanden an der Universitätsklinik Charité, Berlin, Deutschland, wurden bei jedem Probanden vier experimentelle oberflächliche Wunden (5 mm Durchmesser) als ein Modell für akute Wunden mittels Saugblasentechnik und Entfernen des Blasendachs mit Skalpell und steriler Pinzette erzeugt (Tag 1). Vier Behandlungsarten wurden während 10 Tagen angewendet und untersucht: keine Therapie, nur wIRA(+VIS) (ungefähr 75% wIRA, 25% VIS; täglich 30 Minuten Bestrahlung), nur Dexpanthenol-Salbe (= D-Panthenol-Salbe) einmal täglich, wIRA(+VIS) und Dexpanthenol-Salbe einmal täglich. Die Heilung der kleinen experimentellen Wunden war aus klinischer Sicht bei allen 4 Behandlungsarten sehr gut. Deshalb gab es nur kleine Unterschiede zwischen den Behandlungsarten mit geringen Vorteilen für die Kombination wIRA(+VIS) und Dexpanthenol-Salbe und für nur Dexpanthenol-Salbe hinsichtlich der relativen Änderung der Wundfläche und der Einschätzung des Empfindens des Wundgebiets.
Laser-Scan-Mikroskopie mit einem Score-System zeigte jedoch Unterschiede zwischen den vier Behandlungsarten hinsichtlich der Bildung des Stratum corneum (von der ersten Schicht von Korneozyten bis zur vollen Ausbildung) insbesondere für die Tage 5–7: die schnellste Ausbildung des Stratum corneum wurde bei Wunden beobachtet, die mit wIRA(+VIS) und Dexpanthenol-Salbe behandelt wurden, am zweitschnellsten war wIRA(+VIS) allein, an dritter Stelle lag Dexpanthenol-Salbe allein und an letzter Stelle waren die unbehandelten Wunden. Keimzahlbestimmungen der Wunden (alle 2 Tage) zeigten, dass wIRA(+VIS) und die Kombination von wIRA(+VIS) mit Dexpanthenol-Salbe in der Lage waren, die Kolonisation mit physiologischer Hautflora bis zum Tag 5 im Vergleich zu den beiden anderen Gruppen (untherapierte Gruppe und Gruppe mit nur Dexpanthenol-Salbe) zu verhindern. Zu allen untersuchten Zeitpunkten war das Maß an Kolonisation unter Therapie mit wIRA(+VIS) allein niedriger (mehr supprimiert) als in der Gruppe mit wIRA(+VIS) und Dexpanthenol-Salbe [2].
wIRA für Wundserome
Während der Rehabilitation nach Hüft- und Knie-Endoprothesen-Operationen war durch Bestrahlung mit wIRA(+VIS) die Resorption von Wundseromen und Wundhämatomen sowohl klinisch als auch sonographisch schneller und die Schmerzen waren reduziert [2]. Ein zusätzliches Beispiel zeigt Abbildung 12 [Abb. 12].
Abbildung 12: Beispiel für eine erfolgreiche Behandlung rezidivierender Wundserome mit wIRA
Eine 64-jährige Patientin hatte rezidivierende Wundserome und Wundhämatome (ohne Infektion) nach einer Hüftoperation (Ersatz des Pfannenteils einer 15 Jahre alten Hüftendoprothese) selbst nach einer weiteren Operation, die nur mit dem Ziel, die Wundserome zu stoppen, durchgeführt wurde, und nach ungefähr 8 Punktionen von Seromflüssigkeit (bis zu ungefähr 90 ml innerhalb einer Punktion) innerhalb von 2 Monaten, und eine dritte Operation wurde ernsthaft erwogen: Abbildung A zeigt das zugehörige sonographische Bild. Zu diesem Zeitpunkt wurde mit der Bestrahlung mit wIRA(+VIS) begonnen, zunächst mit 30 Minuten zweimal täglich und steigernd bis auf dreimal eine Stunde täglich. Innerhalb weniger Tage nahm das Wundserom nicht mehr wie zuvor üblich zu, nach ungefähr einer Woche war klinisch eine leichte Abnahme der Seromgröße zu beobachten (Abbildung B), Abbildung C zeigt die reduzierte Seromgröße nach 18 Tagen, Abbildung D nach 29 Tagen, und nach ungefähr 2 Monaten hatte sich das Serom ohne eine Punktion von Seromflüssigkeit oder eine Operation seit dem Beginn der Bestrahlung mit wIRA(+VIS) sowohl klinisch wie auch sonographisch völlig aufgelöst (Veröffentlichung der Sonographiebilder mit freundlicher Genehmigung von Dr. Michael Paulus, Herzogenaurach, Deutschland) (aus [2]).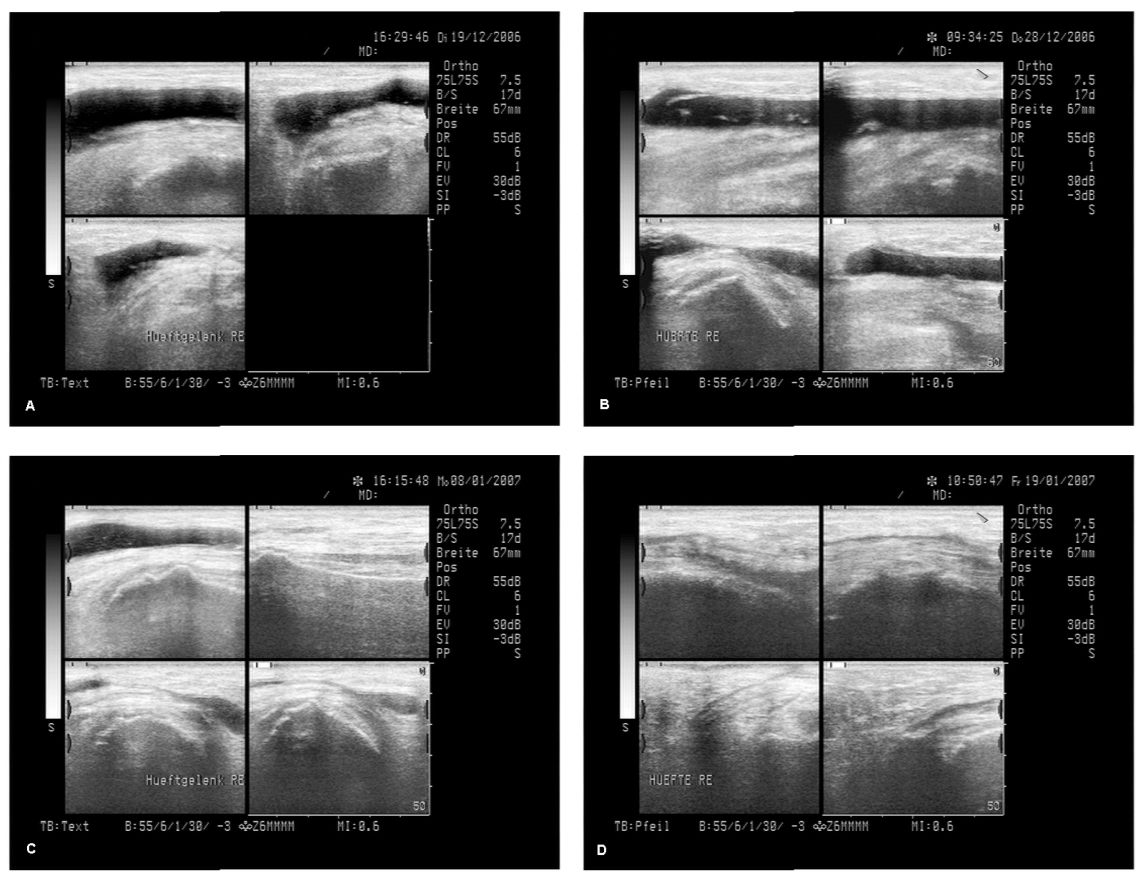
wIRA für persistierende postoperative Schmerzen
wIRA kann erfolgreich bei persistierenden postoperativen Schmerzen z.B. nach Thorakotomie eingesetzt werden [2].
Perspektiven für wIRA für die Heilungsverbesserung akuter Wunden
Als Perspektive für wIRA erscheint es klinisch sinnvoll, wIRA sowohl prä- als auch postoperativ z.B. bei abdominellen und thorakalen Operationen einzusetzen. wIRA kann präoperativ (z.B. während 1–2 Wochen) zur Präkonditionierung der Entnahme- und der Empfängerstellen von Hautlappen, Transplantaten oder Spalthauttransplantaten und postoperativ zum Verbessern der Wundheilung und zum Mindern von Schmerz, Entzündung und Infektion an allen genannten Stellen verwendet werden. wIRA kann zum Unterstützen einer prä- oder postoperativen Routine-Antibiotika-Gabe eingesetzt werden [2].
Therapie chronischer Wunden mit wIRA
Das Zentrum von chronischen Wunden ist oft hypoxisch und relativ hypotherm. Das entspricht einer defizitären Energiebereitstellung im Gewebe, die die Wundheilung behindert oder unmöglich macht. wIRA steigert Temperatur, Sauerstoffpartialdruck sowie die Durchblutung im Gewebe. Diese drei Faktoren sind entscheidend für eine ausreichende Versorgung des Gewebes mit Energie und Sauerstoff und deshalb auch für die Wundheilung, speziell bei chronischen Wunden, und die Infektionsabwehr. wIRA kann insbesondere bei nicht-heilenden chronischen Wunden eine Wundheilung ermöglichen [3].
wIRA für chronische venöse Unterschenkelulzera (Studie in Basel)
In einer prospektiven, randomisierten, kontrollierten Studie mit 40 Patienten mit chronischen venösen Unterschenkelulzera führte eine Bestrahlung mit wIRA und sichtbarem Licht VIS 30 Minuten dreimal pro Woche über 6 Wochen zu einer schnelleren Wundheilung (im Durchschnitt 18 versus 42 Tage bis zum kompletten Wundschluss, Restulkusfläche nach 42 Tagen 0,4 cm² versus 2,8 cm²) und einem geringeren Schmerzmittelverbrauch gegenüber einer in gleicher Form (Wundsäuberung, antibakterielle Wundauflagen und Kompressionstherapie) therapierten, aber nicht bestrahlten Kontrollgruppe [3], [53].
wIRA für chronische venöse Unterschenkelulzera (Studie der Universität Tromsø/Norwegen und des Krankenhauses in Hillerød/Dänemark)
Eine weitere prospektive Studie mit 10 Patienten mit aufwändiger thermographischer Verlaufskontrolle ergab unter Therapie mit wIRA(+VIS) eine vollständige oder fast vollständige Abheilung therapierefraktärer chronischer Unterschenkelulzera bei 7 sowie eine deutliche Ulkusverkleinerung bei 2 weiteren der 10 Patienten, eine ausgeprägte Minderung der Schmerzen und des Schmerzmittelverbrauchs (von z.B. 15 auf 0 Schmerztabletten täglich) und eine Normalisierung des thermographischen Bilds (vor Therapiebeginn typischerweise hyperthermer Ulkusrandwall mit relativ hypothermem Ulkusgrund und bis zu 4,5°C Temperaturdifferenz).
Bei einem Patienten wurde ein Ulkus an einem Bein mit dem Vollwirkstrahler (wIRA(+VIS)) therapiert, während ein Ulkus am anderen Bein mit einem Kontrollgruppenstrahler (nur VIS, ohne wIRA) behandelt wurde, was einen deutlichen Unterschied zugunsten der wIRA-Therapie zeigte.
Alle mit visuellen Analog-Skalen erhobenen Variablen – Einschätzung des Effekts der Bestrahlung durch Patient und durch klinischen Untersucher, Einschätzung des Gefühls im Wundbereich durch Patient, Einschätzung der Wundheilung durch klinischen Untersucher sowie Einschätzung des kosmetischen Zustands durch Patient und durch klinischen Untersucher – verbesserten sich während der Bestrahlungstherapie-Periode sehr stark, was einer verbesserten Lebensqualität entsprach.
Innerhalb der Gruppe der 6 Patienten mit chronischen venösen Unterschenkelulzera ohne Begleitprobleme (d.h. ohne periphere arterielle Verschlusskrankheit, Rauchen oder fehlender venöser Kompressionstherapie) heilten alle 6 Ulzera vollständig oder fast vollständig ab (96–100% Reduktion der Ulkusfläche) [3], [23].
Die Originalveröffentlichung [23] umfasst auch 10 Anhänge mit detaillierten Informationen zu jedem Patienten sowie zusätzlich zwei Thermographie-Videosequenzen.
Ein Beispiel für den Heilungsprozess eines chronischen venösen Unterschenkelulkus unter Therapie mit wIRA ist in der Abbildung 13 [Abb. 13] dargestellt.
Abbildung 13: Beispiel für einen Heilungsverlauf eines chronischen venösen Unterschenkelulkus unter Therapie mit wIRA (Studie Tromsø/Hillerød)
(28-mal 30 Minuten Bestrahlung mit wassergefiltertem Infrarot A (wIRA) und sichtbarem Licht (VIS) innerhalb von 52 Tagen = ca. 7 Wochen) mit normaler Aufsicht, thermographischem Bild und Temperaturprofil durch das Ulkus – jeweils links vor Therapie und rechts nach Abschluss der Therapie. Der Pfeil zeigt im Abschlussthermographiebild auf die Stelle, an der die Wunde war. Durchmesser der roten Kreise: 16 mm. (Studie der Universität Tromsø/Norwegen und des Krankenhauses Hillerød/Dänemark) (adaptiert aus [3], [4], [23])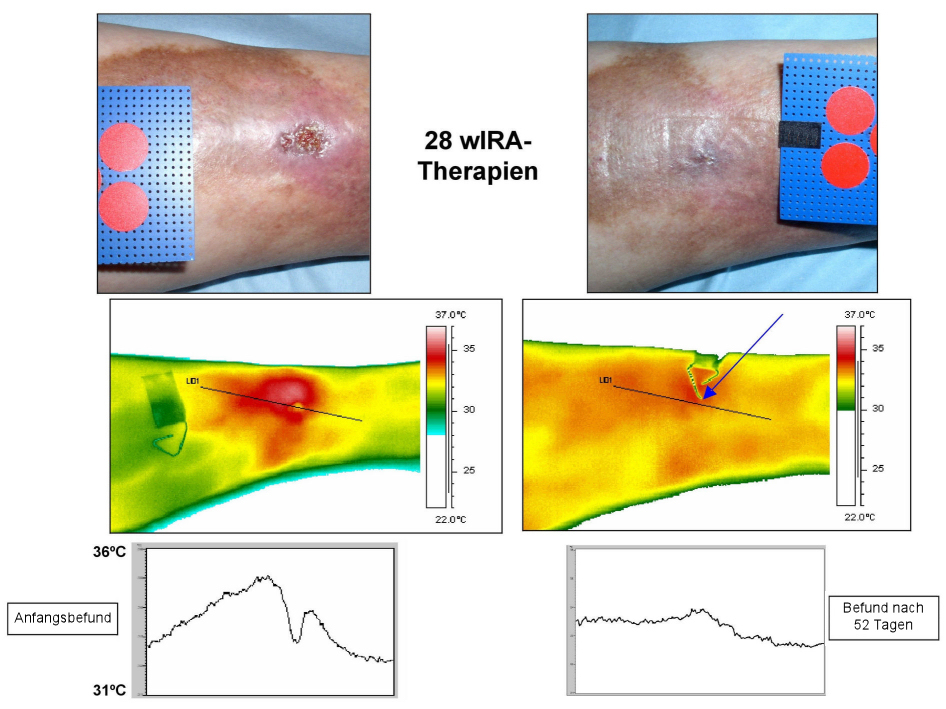
wIRA für chronische venöse Unterschenkelulzera (Studie der Universität Freiburg, Klinik für Dermatologie)
In einer prospektiven, randomisierten, kontrollierten, verblindeten Studie wurden 51 Patienten mit nicht-heilenden chronischen venösen Unterschenkelulzera mit Kompressionstherapie, Wundsäuberung und nicht-adhäsiven Wundauflagen sowie 30 Minuten Bestrahlung fünfmal pro Woche über 9 Wochen behandelt. Eine vorläufige Auswertung zeigte, dass die Gruppe mit wIRA(+VIS) verglichen mit der Kontrollgruppe mit VIS eine schnellere Wundheilung, eine bessere Granulation und in der späteren Phase der Behandlung eine Abnahme der bakteriellen Last der Wunden aufwies [3].
wIRA für chronische venöse Unterschenkelulzera (Beispiel)
Ein zusätzliches Beispiel zeigt Abbildung 14 [Abb. 14].
Abbildung 14: Beispiel für einen Heilungsverlauf eines chronischen venösen Unterschenkelulkus unter Therapie mit wIRA
88-jährige Patientin mit infiziertem (leicht fötide riechendem) verkrustetem Ulkus (am rechten distalen medialen Unterschenkel), das bereits seit 13 Monaten bestand und das sich trotz konservativer dermatologischer Therapie einschließlich lokalem Antiseptikum, systemischem Antibiotikum und nicht-adhäsiver Wundauflage bis auf 10 cm Durchmesser vergrößert hatte. Chronische venöse Insuffizienz mit deutlichen Unterschenkel-Stauungsödemen und großflächiger Stauungsdermatitis, Diabetes mellitus Typ II (oral behandelt), leichtes Übergewicht und eingeschränkter Bewegungsumfang. Unter Bestrahlung mit wIRA(+VIS) 30 Minuten täglich, Kompressionstherapie, lokaler Antisepsis, nicht-adhäsiver Wundauflage und der Möglichkeit, die systemische antibiotische Therapie zu beenden, wurde ein kompletter Wundschluss innerhalb von 4½ Monaten erreicht: Anfangsbefund, Befund nach 3½ Monaten, nach 4½ Monaten (geheilt). (adaptiert aus [3], [4])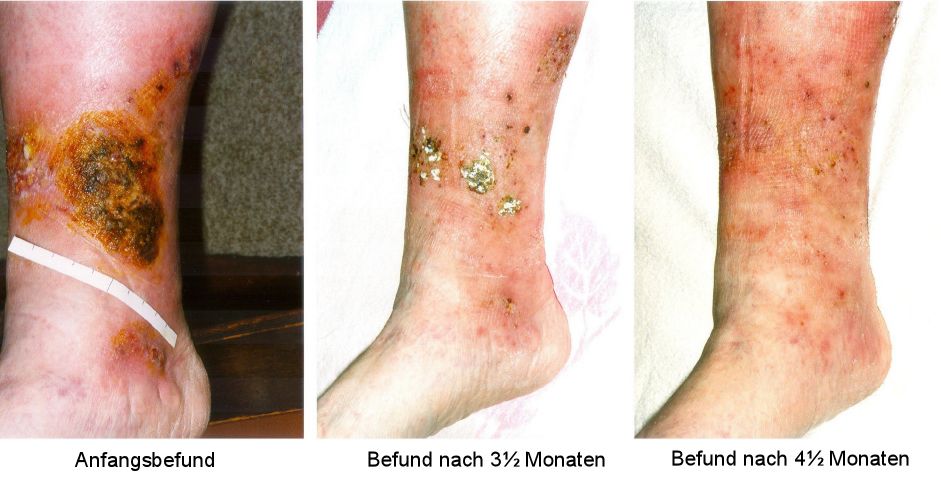
Andere wundbezogene Indikationen für wIRA
Einige Fallberichte haben gezeigt, dass wIRA selbst bei gemischt arteriell-venösen Ulzera oder arteriellen Ulzera eingesetzt werden kann, wenn die Bestrahlungsstärke angemessen niedrig gewählt und die Bestrahlung sorgfältig überwacht wird [3].
wIRA kann bei Dekubitalulzera sowohl präventiv als auch therapeutisch eingesetzt werden [3].
wIRA kann die Resorption topisch applizierter Substanzen [54], [55], [56] auch auf Wunden verbessern [3].
Endogener PDT-ähnlicher Effekt von wIRA
Eine Bestrahlung mit VIS und wIRA wirkt vermutlich in Verbindung mit endogenem Protoporphyrin IX (oder Protoporphyrin IX von Bakterien) quasi wie eine milde photodynamische Therapie (endogener PDT-ähnlicher Effekt). Dies kann die Zellregeneration und Wundheilung fördern und antibakteriell wirken [3], [57].
Perspektiven für wIRA für die Heilungsverbesserung chronischer Wunden
Zusammengefasst zeigen die Ergebnisse, dass wIRA generell für die Behandlung chronischer Wunden empfohlen werden kann [3].
Resümee
wIRA kann Schmerzen deutlich mindern und eine erhöhte Wundsekretion und Entzündung herabsetzen sowie infektionsmindernd wirken. wIRA vermag sowohl bei akuten als auch bei chronischen Wunden die Wundheilung zu beschleunigen oder bei stagnierender Wundheilung günstig zu beeinflussen. Selbst der normale Wundheilungsprozess kann verbessert werden.
wIRA kann generell für die Therapie von akuten und chronischen Wunden empfohlen werden.
Literatur
[1] Hoffmann G. Principles and working mechanisms of water-filtered infrared-A (wIRA) in relation to wound healing [review]. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc54. Online available from: http://www.egms.de/pdf/journals/dgkh/2007-2/dgkh000087.pdf (PDF) and http://www.egms.de/en/journals/dgkh/2007-2/dgkh000087.shtml (shtml).[2] Hartel M, Illing P, Mercer JB, Lademann J, Daeschlein G, Hoffmann G. Therapy of acute wounds with water-filtered infrared-A (wIRA) [review]. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc53. Online available from: http://www.egms.de/pdf/journals/dgkh/2007-2/dgkh000086.pdf (PDF) and http://www.egms.de/en/journals/dgkh/2007-2/dgkh000086.shtml (shtml).
[3] von Felbert V, Schumann H, Mercer JB, Strasser W, Daeschlein G, Hoffmann G. Therapy of chronic wounds with water-filtered infrared-A (wIRA) [review]. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc52. Online available from: http://www.egms.de/pdf/journals/dgkh/2008-2/dgkh000085.pdf (PDF) and http://www.egms.de/en/journals/dgkh/2008-2/dgkh000085.shtml (shtml).
[4] Hoffmann G. Wassergefiltertes Infrarot A (wIRA) zur Verbesserung der Wundheilung [Übersichtsarbeit]. [Water-filtered infrared A (wIRA) for the improvement of wound healing [review]]. GMS Krankenhaushyg Interdiszip. 2006;1(1):Doc20. Online available from: http://www.egms.de/pdf/journals/dgkh/2006-1/dgkh000020.pdf (PDF) and http://www.egms.de/en/journals/dgkh/2006-1/dgkh000020.shtml (shtml).
[5] Hoffmann G. Wassergefiltertes Infrarot A (wIRA) zur Verbesserung der Wundheilung bei akuten und chronischen Wunden [Water-filtered Infrared-A (wIRA) for the improvement of wound healing of acute and chronic wounds]. Wundmanagement. 2008;2:72-80. Also available online from: http://publikationen.ub.uni-frankfurt.de/volltexte/2008/5429/
[6] Hoffmann G. Klinische Anwendungen von wassergefiltertem Infrarot A (wIRA) [Clinical applications of water-filtered infrared-A (wIRA)]. In: Kaase H, Serick F, Hrsg. Sechstes Symposium "Licht und Gesundheit" [Sixth symposium "Light and health"]. Eine Sondertagung der Technischen Universität Berlin und der Deutschen Gesellschaft für Photobiologie mit der Deutschen Akademie für Photobiologie und Phototechnologie und der Deutschen Lichttechnischen Gesellschaft, Berlin, 13./14.03.2008. Berlin; 2008. S. 130-46. ISBN: 3-9807635-0-3. Also available online from: http://publikationen.ub.uni-frankfurt.de/volltexte/2008/5484/ (online version includes English and German abstract).
[7] Fuchs SM, Fluhr JW, Bankova L, Tittelbach J, Hoffmann G, Elsner P. Photodynamic therapy (PDT) and waterfiltered infrared A (wIRA) in patients with recalcitrant common hand and foot warts. Ger Med Sci. 2004;2:Doc08. Online available from: http://www.egms.de/pdf/gms/2004-2/000018.pdf (PDF) and http://www.egms.de/en/gms/2004-2/000018.shtml (shtml).
[8] Cobarg CC. Physikalische Grundlagen der wassergefilterten Infrarot-A-Strahlung [Principles of the physical properties of water-filtered infrared-A radiation]. In: Vaupel P, Krüger W, Hrsg. Wärmetherapie mit wassergefilterter Infrarot-A-Strahlung [Thermal therapy with water-filtered infrared-A radiation]. Grundlagen und Anwendungsmöglichkeiten [The fundamentals and applications]. 2. Aufl. Stuttgart: Hippokrates; 1995. S. 19-28.
[9] Rzeznik J. Die Technik zur loko-regionalen Wärmetherapie mit wassergefilterter Infrarot-A-Strahlung [The technique of loco-regional thermal therapy with water-filtered infrared-A radiation]. In: Vaupel P, Krüger W, Hrsg. Wärmetherapie mit wassergefilterter Infrarot-A-Strahlung [Thermal therapy with water-filtered infrared-A radiation]. Grundlagen und Anwendungsmöglichkeiten [The fundamentals and applications]. 2. Aufl. Stuttgart: Hippokrates; 1995. S. 29-46.
[10] Albrecht-Buehler G. Surface extensions of 3T3 cells towards distant infrared light sources. J Cell Biol. 1991;114(3):493-502. DOI: 10.1083/jcb.114.3.493
[11] Albrecht-Buehler G. Cellular infrared detector appears to be contained in the centrosome. Cell Motil Cytoskeleton. 1994;27(3):262-71. DOI: 10.1002/cm.970270307
[12] Albrecht-Buehler G. A long-range attraction between aggregating 3T3 cells mediated by near-infrared light scattering. Proc Natl Acad Sci U S A. 2005;102(14):5050-5. Epub 2005 Mar 24. DOI: 10.1073/pnas.0407763102
[13] Ehrlicher A, Betz T, Stuhrmann B, Koch D, Milner V, Raizen MG, Käs J. Guiding neuronal growth with light. Proc Natl Acad Sci USA. 2002;99(25):16024-8. DOI: 10.1073/pnas.252631899
[14] Karu TI, Pyatibrat LV, Kalendo GS. Cell attachment to extracellular matrices is modulated by pulsed radiation at 820 nm and chemicals that modify the activity of enzymes in the plasma membrane. Lasers Surg Med. 2001;29(3):274-81. DOI: 10.1002/lsm.1119
[15] Karu TI, Pyatibrat LV, Kalendo GS. Donors of NO and pulsed radiation at lambda = 820 nm exert effects on cell attachment to extracellular matrices. Toxicol Lett. 2001;121(1):57-61. DOI: 10.1016/S0378-4274(01)00315-0
[16] Karu TI, Pyatibrat LV, Kalendo GS. Cell attachment modulation by radiation from a pulsed light diode (lambda = 820 nm) and various chemicals. Lasers Surg Med. 2001;28(3):227-36. DOI: 10.1002/lsm.1043
[17] Chow RT, Heller GZ, Barnsley L. The effect of 300 mW, 830 nm laser on chronic neck pain: a double-blind, randomized, placebo-controlled study. Pain. 2006;124(1-2):201-10. Epub 2006 Jun 27. DOI: 10.1016/j.pain.2006.05.018
[18] Gebbers N, Hirt-Burri N, Scaletta C, Hoffmann G, Applegate LA. Water-filtered infrared-A radiation (wIRA) is not implicated in cellular degeneration of human skin. GMS Ger Med Sci. 2007;5:Doc08. Online available from: http://www.egms.de/pdf/gms/2007-5/000044.pdf (PDF) and http://www.egms.de/en/gms/2007-5/000044.shtml (shtml).
[19] Hartel M, Hoffmann G, Wente MN, Martignoni ME, Büchler MW, Friess H. Randomized clinical trial of the influence of local water-filtered infrared A irradiation on wound healing after abdominal surgery. Br J Surg. 2006;93(8):952-60. DOI: 10.1002/bjs.5429
[20] Vaupel P, Rzeznik J, Stofft E. Wassergefilterte Infrarot-A-Strahlung versus konventionelle Infrarotstrahlung: Temperaturprofile bei lokoregionaler Wärmetherapie [Water-filtered infrared-A radiation versus conventional infrared-A radiation: temperature profiles upon loco-regional thermotherapy]. Phys Rehab Kur Med. 1995;5:77-81. DOI: 10.1055/s-2008-1061959
[21] Stofft E, Vaupel P. Wassergefilterte Infrarot-A-Strahlung versus Fango-Paraffin-Packung: Temperaturprofile bei lokoregionaler Wärmetherapie [Water-filtered infrared-A radiation versus fango-paraffin pack: temperature profiles upon loco-regional thermotherapy]. Phys Rehab Kur Med. 1996;6:7-11. DOI: 10.1055/s-2008-1061893
[22] Vaupel P, Stofft E. Wassergefilterte Infrarot-A-Strahlung im Vergleich zu konventioneller Infrarotstrahlung oder Fango-Paraffin-Packungen: Temperaturprofile bei lokaler Wärmetherapie [Water-filtered infrared-A radiation in comparison to conventional infrared-A radiation or fango paraffin packages: temperature profiles in local thermal therapy]. In: Vaupel P, Krüger W, Hrsg. Wärmetherapie mit wassergefilterter Infrarot-A-Strahlung [Thermal therapy with water-filtered infrared-A radiation]. Grundlagen und Anwendungsmöglichkeiten [The fundamentals and applications]. 2. Aufl. Stuttgart: Hippokrates; 1995. S. 135-47.
[23] Mercer JB, Nielsen SP, Hoffmann G. Improvement of wound healing by water-filtered infrared-A (wIRA) in patients with chronic venous stasis ulcers of the lower legs including evaluation using infrared thermography. GMS Ger Med Sci. 2008;6:Doc11. Online available from: http://www.egms.de/pdf/gms/2008-6/000056.pdf (PDF) and http://www.egms.de/en/gms/2008-6/000056.shtml (shtml).
[24] Mercer JB, de Weerd L. The effect of water-filtered infrared-A (wIRA) irradiation on skin temperature and skin blood flow as evaluated by infrared thermography and scanning laser Doppler imaging. Thermology Int. 2005;15(3):89-94.
[25] Pascoe DD, Mercer JB, de Weerd L. Physiology of thermal signals. In: Bronzino JD, ed. Biomedical Engineering Handbook. 3rd edition. Boca Raton (Florida/USA): Tailor and Francis Group, CRC press; 2006. p. 21-1 - 21-20.
[26] Hellige G, Becker G, Hahn G. Temperaturverteilung und Eindringtiefe wassergefilterter Infrarot-A-Strahlung [Temperature distribution and penetration depth of water-filtered infrared-A radiation]. In: Vaupel P, Krüger W, Hrsg. Wärmetherapie mit wassergefilterter Infrarot-A-Strahlung [Thermal therapy with water-filtered infrared-A radiation]. Grundlagen und Anwendungsmöglichkeiten [The fundamentals and applications]. 2. Aufl. Stuttgart: Hippokrates; 1995. S. 63-79.
[27] Melling AC, Ali B, Scott EM, Leaper DJ. Effects of preoperative warming on the incidence of wound infection after clean surgery: a randomised controlled trial. Lancet. 2001;358(9285):876-80. DOI: 10.1016/S0140-6736(01)06071-8
[28] Plattner O, Akca O, Herbst F, Arkilic CF, Függer R, Barlan M, Kurz A, Hopf H, Werba A, Sessler DI. The influence of 2 surgical bandage systems on wound tissue oxygen tension. Arch Surg. 2000;135(7):818-22. DOI: 10.1001/archsurg.135.7.818
[29] Kivisaari J, Vihersaari T, Renvall S, Niinikoski J. Energy metabolism of experimental wounds at various oxygen environments. Ann Surg. 1975;181:823-8. DOI: 10.1097/00000658-197506000-00011
[30] Kühne HH, Ullmann U, Kühne FW. New aspects on the pathophysiology of wound infection and wound healing - the problem of lowered oxygen pressure in the tissue. Infection. 1985;13(2):52-6. DOI: 10.1007/BF01660413
[31] Niinikoski J, Gottrup F, Hunt TK. The role of oxygen in wound repair. In: Janssen H, Rooman R, Robertson JIS, eds. Wound healing. Petersfield: Wrightson Biomedical Publishing; 1991. p. 165-74.
[32] Hoffmann G. Improvement of wound healing in chronic ulcers by hyperbaric oxygenation and by waterfiltered ultrared A induced localized hyperthermia. Adv Exp Med Biol. 1994;345:181-8.
[33] Buslau M, Hoffmann G. Hyperbaric oxygenation in the treatment of skin diseases [review]. In: Fuchs J, Packer L, eds. Oxidative stress in dermatology. New York: Marcel Dekker; 1993. p. 457-85.
[34] Buslau M, Hoffmann G. Die hyperbare Oxygenation (HBO) - eine adjuvante Therapie akuter und chronischer Wundheilungsstörungen [Review] [Hyperbaric oxygenation - an adjuvant therapy of acute and chronic wound healing impairments]. Dermatol Monatsschr. 1993;179:39-54.
[35] Hoffmann G, Buslau M. Treatment of skin diseases by hyperbaric oxygenation. In: Cramer FS, ed. In: Proceedings of the Eleventh International Congress on Hyperbaric Medicine. Flaggstaff, USA: Best Publishing Company; 1995. p. 20-1, 153-9.
[36] Wright J. Hyperbaric oxygen therapy for wound healing. World Wide Wounds; 2001. Online available from: http://www.worldwidewounds.com/2001/april/Wright/HyperbaricOxygen.html
[37] Knighton DR, Silver IA, Hunt TK. Regulation of wound-healing angiogenesis - effect of oxygen gradients and inspired oxygen concentration. Surgery. 1981;90:262-70.
[38] Jünger M, Hahn M, Klyscz T, Steins A. Role of microangiopathy in the development of venous leg ulcers. Basel: Karger; 1999. p. 180-93. (Progr. Appl. Microc.; Vol. 23.).
[39] Karu TI. Primary and secondary mechanisms of action of visible to near-IR radiation on cells [review]. J Photochem Photobiol B. 1999;49(1):1-17. DOI: 10.1016/S1011-1344(98)00219-X
[40] Karu TI. Low-power laser effects. In: Waynant RW, editor. Lasers in medicine. Boca Raton: CRC Press; 2002. p. 171-209.
[41] Danno K, Mori N, Toda K, Kobayashi T, Utani A. Near-infrared irradiation stimulates cutaneous wound repair: laboratory experiments on possible mechanisms. Photodermatol Photoimmunol Photomed. 2001;17(6):261-5.
[42] Horwitz LR, Burke TJ, Carnegie D. Augmentation of wound healing using monochromatic infrared energy. Exploration of a new technology for wound management. Adv Wound Care. 1999;12(1):35-40.
[43] Menezes S, Coulomb B, Lebreton C, Dubertret L. Non-coherent near infrared radiation protects normal human dermal fibroblasts from solar ultraviolet toxicity. J Invest Dermatol. 1998;111(4):629-33. DOI: 10.1046/j.1523-1747.1998.00338.x
[44] Frank S, Menezes S, Lebreton-De Coster C, Oster M, Dubertret L, Coulomb B. Infrared radiation induces the p53 signaling pathway: role in infrared prevention of ultraviolet B toxicity. Exp Dermatol. 2006;15(2):130-7. DOI: 10.1111/j.1600-0625.2005.00397.x
[45] Frank S, Oliver L, Lebreton-De Coster C, Moreau C, Lecabellec MT, Michel L, Vallette FM, Dubertret L, Coulomb B. Infrared radiation affects the mitochondrial pathway of apoptosis in human fibroblasts. J Invest Dermatol. 2004;123(5):823-31. DOI: 10.1111/j.0022-202X.2004.23472.x
[46] Danno K, Horio T, Imamura S. Infrared radiation suppresses ultraviolet B-induced sunburn-cell formation. Arch Dermatol Res. 1992;284(2):92-4. DOI: 10.1007/BF00373376
[47] Applegate LA, Scaletta C, Panizzon R, Frenk E, Hohlfeld P, Schwarzkopf S. Induction of the putative protective protein ferritin by infrared radiation: implications in skin repair. Int J Mol Med. 2000;5(3):247-51.
[48] Burri N, Gebbers N, Applegate LA. Chronic infrared-A radiation repair: Implications in cellular senescence and extracellular matrix. In: Pandalai SG, ed. Recent Research Developments in Photochemistry & Photobiology, vol. 7. Trivandrum: Transworld Research Network; 2004. p. 219-31.
[49] Hoffmann G, Meffert H. Apparent contradiction between negative effects of UV radiation and positive effects of sun exposure. GMS Ger Med Sci. 2005;3:Doc01. Online available from: http://www.egms.de/pdf/gms/2005-3/000019.pdf (PDF) and http://www.egms.de/en/gms/2005-3/000019.shtml (shtml).
[50] Jung T, Höhn A, Piazena H, Grune T. Effects of water-filtered infrared A irradiation on human fibroblasts. Free Radic Biol Med. 2009 Oct 21. DOI: 10.1016/j.freeradbiomed.2009.10.036
[51] Piazena H, Kelleher DK. Effects of infrared-A irradiation on skin: discrepancies in published data highlight the need for an exact consideration of physical and photobiological laws and appropriate experimental settings. Photochem Photobiol. 2009: accepted.
[52] Hoffmann G. Wassergefiltertes Infrarot A (wIRA) in der Wundbehandlung: Interview; 3 Fragen an Prof. Dr. med. Gerd Hoffmann [Water-filtered infrared-A (wIRA) in the treatment of wounds: interview; 3 questions to Prof. Gerd Hoffmann, MD]. Heilberufe. 2009;61(7):14. Also available online from: http://publikationen.ub.uni-frankfurt.de/volltexte/2009/6802/ [The online version includes an English and a German abstract].
[53] Biland L, Barras J. Die wassergefilterte Infrarot-A-Hyperthermie zur Behandlung venöser Ulcera [Water-filtered infrared-A induced hyperthermia used as therapy of venous ulcers]. Hefte Wundbehand. 2001;5:41.
[54] Haupenthal H. In vitro- und in vivo-Untersuchungen zur temperaturgesteuerten Arzneistoff-Liberation und Permeation [Thesis] [In vitro and in vivo investigations of temperature dependent drug liberation and permeation]. Mainz: Johannes Gutenberg-Universität; 1997.
[55] Bankova L, Heinemann C, Fluhr JW, Hoffmann G, Elsner P. Improvement of penetration of a topical corticoid by waterfiltered infrared A (wIRA). In: 1st Joint Meeting 14th International Congress for Bioengineering and the Skin & 8th Congress of the International Society for Skin Imaging; 2003 May 21-24; Hamburg; 2003. P96.
[56] Otberg N, Grone D, Meyer L, Schanzer S, Hoffmann G, Ackermann H, Sterry W, Lademann J. Water-filtered infrared-A (wIRA) can act as a penetration enhancer for topically applied substances. GMS Ger Med Sci. 2008;6:Doc08. Online available from: http://www.egms.de/pdf/gms/2008-6/000053.pdf (PDF) and http://www.egms.de/en/gms/2008-6/000053.shtml (shtml).
[57] Hoffmann G. Wassergefiltertes Infrarot A (wIRA) [Water-filtered infrared-A (wIRA)]. In: Kramer A, Assadian O, Hrsg. Wallhäußers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung. Qualitätssicherung der Hygiene in Industrie, Pharmazie und Medizin. [Wallhäußer's practice of sterilization, disinfection, antisepsis and conservation. Quality assurance of the hygiene in industry, pharmacy, and medicine]. Stuttgart: Thieme; 2008. S. 899-900. ISBN: 978-3-13-141121-1. Also available online from: http://publikationen.ub.uni-frankfurt.de/volltexte/2009/6135/ [The online version includes an English and a German abstract].
[58] Carter DR, ed. Electro-Optics Handbook [company publication]. Lancester, PA, USA: Burle Industries; c2008. Section 6, p. 61-80. Online available from: http://www.burle.com/cgi-bin/byteserver.pl/pdf/Electro_Optics.pdf
[59] Valley SL, ed. Handbook of geophysics and space environments. Air Force Cambridge Research Laboratories, Office of Aerospace Research, U.S. Air Force; 1965. Also published: New York, N.Y.: McGraw-Hill Book Co.; 1965.




